






 Рейтинг: 4.4/5.0 (1757 проголосовавших)
Рейтинг: 4.4/5.0 (1757 проголосовавших)Категория: Инструкции
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ТРЕХ ТЕСТ-СИСТЕМ ДЛЯ ИДЕНТИФИКАЦИИ СТАФИЛОКОККОВ: ПБДС (РОССИЯ), STAPHYTEST-16" (ЧЕХИЯ) И "API-STAPH" (ФРАНЦИЯ)
Целью настоящей работы явилось сравнительное изучение диагностической эффективности трех тест-систем для идентификации стафилококков с определением причин возможных ошибок. При этом внимание было акцетировано на вопросах их диагностической информативности, поскольку конечный результат идентификации как вероятностный показатель зависит не только от качества работы отдельных биохимических тестов, но (в первую очередь) и от спектра ферментативных реакций, включенных изготовителем в состав диагностической панели. При проведении работы использованы 23 эталонных штамма стафилококков с известными видовой принадлежностью и биохимическими характеристиками. Штаммы были получены из музея живых бактериальных культур. Данные культуры были одновременно исследованы с помощью тест-систем ПБДС (НПО "Диагностические системы", Россия), "STAPHYtest-16" ("Lachema") и "API-Staph" ("BioMerieux") в соответствии с прилагаемыми к ним инструкциями. Кроме тестов, размещенных в лунках панелей, в соответствии с теми же инструкциями дополнительно проводили ряд пробирочных проб (плазмокоагулаза при использовании ПБДС) или тестов на полосках (оксидаза и продукция ацетона при использовании "STAPHYtest-16"). Тест-система ПБДС (пластина биохимическая дифференцирующая стафилококки) позволяет определить у идентифицируемых микроорганизмов 17 биохимических характеристик, в том числе аэробную утилизацию 12 сахаров, аминокислоты аргинина (анаэробно), продукцию aцетоина, наличие уреазы (анаэробно), щелочной фосфатазы и нитратредуктазы. Помимо этого, инструкцией к тест-системе предусмотрено дополнительное определение у исследуемых культур наличия плазмокоагулазы.
Издание: Клиническая лабораторная диагностика
Год издания: 2004
Объем: 4с.
Дополнительная информация: 2004.-N 4.-С.42-45
Просмотров: 171
Продукты и услуги Информационно-правовое обеспечение ПРАЙМ Документы ленты ПРАЙМ Письмо Федеральной службы по надзору в сфере здравоохранения от 10 июня 2014 г. N 01И-824/14 "О новых данных по безопасности медицинского изделия"
 Обзор документа
Обзор документа
Федеральная служба по надзору в сфере здравоохранения в рамках исполнения государственной функции по мониторингу безопасности медицинских изделий, находящихся в обращении на территории Российской Федерации доводит до сведения специалистов здравоохранения письмо компании ООО "биоМерье Рус" о новых данных по безопасности некоторых реагентов для проведения биохимических тестов, производства "биоМерье СА", Франция.
Приложение: на 5 л. в 1 экз.
Информационное письмо 27 марта 2014Глубокоуважаемый Клиент компании *,
Мы благодарим Вас за использование продукции API компании биоМерье. Согласно имеющейся у нас информации, вы получили один из следующих продуктов (номера партий: см. Приложение 1 ):
Номер по каталогу
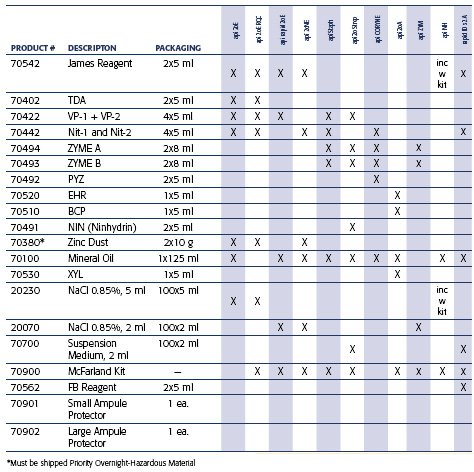
Компанией биоМерье определен визуальный дефект и проблемы с активностью реагентов FB (Кат. N 70562) и ZYM В (Кат. N 70493). Данные реагенты используются для проведения некоторых биохимических тестов, входящих в состав следующих стрипов для идентификации:
Стрипы для идентификации, в которых используется реагент FB
Стрипы для идентификации, в которых используется реагент ZYM B
API Campy (20800)
API 20 Strep (20600)
ID 32 Staph (32500)
API Coryne (20900)
Rapid 10 32A ( 32300)
API Staph (20500)
Rapid ID 32 Strep (32600)
API Listeria (10300)
Все эти продукты (API и ID 32), за исключением API ZYM (25200), являются стандартизованными системами, состоящими из нескольких биохимических тестов, которые позволяют проводить групповую или видовую идентификацию большинства микроорганизмов. API ZYM (25200) представляет собой полуколичественный микро-метод, разработанный для исследования ферментативной активности и не используется для идентификации микроорганизмов.
Влияние при рутинном использовании:
Исследование, проведенное нашей лабораторией контроля качества показало, что цвет реагента FB становится нестабильным через некоторое время после восстановления. Такое изменение окраски FB реагента после его растворения приводит к визуальному дефекту продукта, который приводит к сомнительным результатом (+/-) некоторых биохимических тестов API и ID 32 с использованием реагента FB. Оценка влияния активности FB на результаты исследования показала, что не один вид микроорганизмов не дает неправильной идентификации. Однако, увеличилось количество случаев отсутствия идентификации для некоторых штаммов. Если ампулы FB имеют соответствующий цвет (от желтого до оранжево-желтого после восстановления), риска возникновения проблем с производительностью нет.
Потенциальный риск связан с появлением результата "нет идентификации" микроорганизмов на стрипах API Campy, ID 32 Staph, Rapid ID 32 А и Rapid ID 32 Strep. Однако, такой результат обозначается как "неприемлемый" или "сомнительный" в таблице результатов. Таким образом, неверный результат идентификации не может быть выдан врачу. Данные результаты нуждаются в подтверждении альтернативными методами.
Исследование, проведенное нашей лабораторией контроля качества показало, что вопрос активности затронутых партий реагента ZYM В (см. Приложение 1), не зависит от цвета ампул ZYM В (соответствует или не соответствует). Эта проблема активности приводит к ложному отрицательному результату некоторых биохимических тестов на стрипах API, использующих реагент ZYM В.
Оценка влияния активности ZYM В на результаты исследований показала, что данная проблема может привести к неправильной идентификации некоторых видов на стрипах API 20 Strep, API NH, API Listeria и API Соrune. На API Staph нет риска неправильной идентификации. Однако, возможно получение результатов "нет идентификации". API ZYM разработан для исследования ферментативной активности, для идентификации микроорганизмов не используется.
В заключение, потенциальный риск связан с проблемой получения ошибочных результатов идентификации микроорганизмов на стрипах API 20 Strep, API NH, API Listeria и API Coryne.
- API 20 Strep (Кат. N 20600):
Для 13-ти видов могут быть получены неправильные результаты идентификации: Alloiococcus otitis, Enterococcus avium, Enterococcus durans, Enterococcus faecalis, Enterococcus facium, Enterococcus casseliflavus, Enterococcus gallinarum, Streptococcus agalactiae, Streptococcus anginosus, Streptococcus dys.ssp dysagalactiae, Streptococcus dys.ssp equisimilis, Streptococcus pyogenes, Streptococcus salivarius. Данные виды идентифицируются следующим образом:
Название видов в базе данных
Название видов, полученных в результате ошибки
Corynebacterium.striatum/amycolatum Listeria grayi Rhodococcus spp Corynebacterium propinquum
В настоящий момент, мы просим Вас принять следующие меры:
1. Убедитесь, что данное письмо и руководство были распространены и изучены всеми заинтересованными лицами в вашей организации.
2. Если у Вас все еще имеются в наличии наборы реагента FB (70562), просим вас выполнить следующие обязательные требования:
Восстановите реагент как минимум, за 12 часов до использования. В дальнейшем необходимо проверять цвет реагента FB перед каждым использованием:
- Если цвет желтый - желто-оранжевый (как описано в инструкции): реагент FB может быть использован в течение максимум пяти дней.
- Если цвет оранжевый, темно-янтарный или красный, прекратите использовать и уничтожьте эту капельницу-бутылку. Свяжитесь с местным представителем компании биоМерье для замены продукции.
3. Если у Вас все еще имеются в наличии наборы ZYM В (70493), API NH (10400) и API Listeria (10300), просим вас проверять внешний вид ZYM В (70493) перед каждым использованием и:
a) Для ампул ZYM B, имеющих визуальный дефект (цвет не соответствует описанному в инструкции) прекратите использовать их и уничтожьте наборы. Свяжитесь с местным представителем компании биоМерье для замены продукции.
b) Для ампул ZYM В, не имеющим визуального дефекта, продолжайте их использовать с обязательным требованием: выполняйте ежедневный контроль качества со следующими штаммами АТСС, описанными в инструкции по использованию для каждого стрипа API.
API ZYM (Кат. N 25200)
Pseudomonas aeruginosa ATCC 27853 * Sigma G0395
с) Кроме того, мы рекомендуем Вам обсудить с руководителем лаборатории оценку воздействия и определить, есть ли необходимость в проведении ретроспективного анализа.
План действий компании биоМерье:
Долгосрочный план находится в разработке с целью поиска других решений по устранению данной проблемы. Проверка этих изменений продолжается. До тех пор мы просим вас выполнять обязательные требования по ликвидации любых дефектных реагентов во всех сериях.
В следующие партии реагентов FB (70562), ZYM В (70493), API NH (10400) и API Listeria (10300) будет вложена инструкция, объясняющая обязательные действия описанные в этом письме.
Компания bioMerieux стремится предоставлять клиентам продукцию наивысшего качества. Мы приносим извинения за причиненные неудобства. Если вам требуется дополнительная помощь или у вас есть вопросы, пожалуйста, свяжитесь с местным представителем службы поддержки клиентов компании *.
Благодарим Вас за то, вы продолжаете пользоваться продукцией компании bioMerieux.
Приложение 1 - Вовлеченные партииНомер по каталогу
Обзор документаПриводится письмо компании ООО "биоМерье Рус" о новых данных по безопасности некоторых реагентов для проведения биохимических тестов, производства "биоМерье СА" (Франция).
Сообщается о выявлении визуального дефекта и проблемы с активностью реагентов FB (Кат. N 70562) и ZYM В (Кат. N 70493). Данные реагенты используются для проведения некоторых биохимических тестов, входящих в состав отдельных стрипов для идентификации (API Campy (20800), ID 32 Staph (32500), API 20 Strep (20600), API Coryne (20900) и тд.).
Так, в частности, исследование показало, что цвет реагента FB становится нестабильным через некоторое время после восстановления. Такое изменение окраски FB реагента после его растворения приводит к визуальному дефекту продукта, который приводит к сомнительным результатом (+/-) некоторых биохимических тестов API и ID 32 с использованием реагента FB.
Для получения дополнительной помощи или при возникновении вопросов необходимо связаться с представителем службы поддержки клиентов компании bioMerieux.
Для просмотра актуального текста документа и получения полной информации о вступлении в силу, изменениях и порядке применения документа, воспользуйтесь поиском в Интернет-версии системы ГАРАНТ:

Получите полный доступ к системе ГАРАНТ бесплатно на 3 дня!

© ООО "НПП "ГАРАНТ-СЕРВИС", 2016. Система ГАРАНТ выпускается с 1990 года. Компания "Гарант" и ее партнеры являются участниками Российской ассоциации правовой информации ГАРАНТ.
Все права на материалы сайта ГАРАНТ.РУ принадлежат ООО "НПП "ГАРАНТ-СЕРВИС". Полное или частичное воспроизведение материалов возможно только по письменному разрешению правообладателя. Правила использования портала.
Портал ГАРАНТ.РУ зарегистрирован в качестве сетевого издания Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзором), Эл № ФС77-58365 от 18 июня 2014 года.
ООО "НПП "ГАРАНТ-СЕРВИС", 107076, г. Москва, ул. Стромынка, д. 19, к. 2, internet@garant.ru .
8-800-200-88-88
(бесплатный междугородный звонок)
Отдел рекламы: +7 (495) 647-62-38 (доб. 3153), adv@garant.ru. Реклама на портале.Медиакит
Если вы заметили опечатку в тексте,
выделите ее и нажмите Ctrl+Enter

Референсный метод идентификации
Системы API быстро стали референсным методом идентификации во всем мире, благодаря простоте в использовании и прекрасным рабочим характеристикам:
более 2000 научных публикаций ссылаются на системы API (в том числе - более 600 публикаций только на систему API 20 E),
системы API давно используются для оценки рабочих характеристик других методов/систем идентификации,
благодаря системам API были выделены новые бактериальные виды (напр. в родах Staphylococcusи Streptococcus).
Самая обширная база данных
В настоящее время галерея API предлагает самый полный спектр систем для идентификации. Она включает 15 систем, покрывающих практически все группы бактерий и грибов; всего - более 600 видов. В том числе, галерея APIпредлагает стрипы для идентификации коринебактерий,Campylobacter spp. Listeria spp. Neisseria spp.
Идентификация грамотрицательных бактерий
API 20 E®
Идентификация грамотрицательных палочек за 18-24 часа
База данных включает практически все встречающиеся в клинической практике виды
Референсный метод для оценки характеристик других систем идентификации (600 публикаций)
Быстрота и простота в использовании: нужна одна колония, инструкции по заполнению стрипа указаны прямо на стрипе, стрипы запечатаны в пакеты, цвета реакций четко различимы, специальное программное обеспечение для интерпретации результатов
Длительный срок хранения
Экспресс-идентификация энтеробактерий за 4 часа
База данных включает практически все встречающиеся в клинической практике виды
Система адаптирована для критических ситуаций: быстрое назначение терапии, упрощенный режим работы лаборатории
Достоверный результат: используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур
Простота в использовании
Длительный срок хранения
Идентификация неферментирующих грамотрицательных палочек за 24-48 часов
Система выбора для идентификации бактерий-оппортунистов, являющихся частыми возбудителями внутрибольничных инфекций (поскольку эти бактерии становятся все более и более устойчивыми к антибиотикам, точная идентификация необходима)
Тесты для определения ферментативной активности и способности утилизировать углеводы, адаптированные для неферментирующих бактерий; референсная система в идентификации неферментирующих бактерий
Достоверный результат: используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур.
Идентификация грамотрицательных палочек по упрощенной схеме за 18-24 часа
Упрощенный вариант стрипа API 20 E (10 тестов вместо 20)
Быстрота и простота в использовании: нужна одна колония, инструкции по заполнению стрипа указаны прямо на стрипе, стрипы запечатаны в пакеты, цвета реакций четко различимы, специальное программное обеспечение для интерпретации результатов
Идентификация грибов
API Candida
Идентификация дрожжей, наиболее часто встречающихся в клинической практике, за 18-24 часа
Эффективность: 12 биохимических тестов для идентификации дрожжей
Система адаптирована к современным потребностям: идентификация 14 наиболее часто встречающихся в клинической практике видов дрожжей
Простота в использовании: спонтанное изменение цвета реакции, цвета четко различимы, интерпретация при помощи короткого списка профилей
Готовый к использованию продукт, не нужно дополнительных реактивов (среды для приготовления суспензии включены в набор)
Идентификация дрожжей за 18-24 часа
Тесты для определения способности утилизировать углеводы = референсные тесты в идентификации дрожжей
Простота в использовании: наличие положительного и отрицательного контроля для облегчения учета результата, не нужно дополнительных реактивов
Расширенная база данных, включающая практически все виды, встречающиеся в клинической и ветеринарной практике
Идентификация стафилококков и микрококков за 18-24 часа
Стандартные биохимические тесты и ферментационные тесты = референсные тесты в идентификации стафилококков
Достоверный результат: используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур
Очень простой метод: приготовление суспензии осуществляется прямо в питательной среде APIStaph
Идентификация стрептококков
API 20 Strep
Идентификация стрептококков и родственных бактерий за 4 или 24 часа
Точная идентификация до вида (что важно для эпидемиологии и антибиотикотерапии, поскольку патогенный потенциал и другие свойства различных видов могут сильно варьировать в пределах одной серологической группы)
Простота в использовании и достоверный результат: идентификация родственных бактерий, которые иногда трудно определить в окрашенном по Граму мазке и дифференцировать от стрептококков.
Идентификация анаэробных бактерий
API 20 A®
Идентификация анаэробных бактерий за 24-48 часов
Ферментационные тесты = референсные тесты в идентификации анаэробов
Простота в использовании: приготовление суспензии осуществляется прямо в питательной среде API 20A
Многопараметрическая система для идентификации всех анаэробных бактерий, грамположительных и грамотрицательных
Другие группы бактерий
Идентификация коринеформных бактерий за 24 часа
Система выбора для идентификации бактерий-оппортунистов, являющихся частыми возбудителями внутрибольничных инфекций
Единственная система для идентификации коринебактерий
Простая, достоверная идентификация коринеформных бактерий, которых трудно охарактеризовать в мазке, окрашенном по Граму
Стандартные биохимические тесты и ферментационные тесты = референсные тесты в идентификации коринебактерий
Упаковка содержит 12 тестов, что удобно, поскольку коринебактерии не часто встречаются в клинической практике
Идентификация всех видов рода Listeria за 24 часа
Единственная система для идентификации всехвидов рода Listeria, в том числе Listeriamonocytogenes, без CAMP-теста, с использованием оригинального запатентованного биохимического теста (DIM)
Достоверный результат: в стрип включены специфические тесты для дифференциации родаListeria от других родов со сходной морфологией; используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур
Простота в использовании: приготовление суспензии осуществляется прямо в питательной среде
Идентификация Neisseria spp. Haemophilus spp. иMoraxella catarrhalis (Branhamella catarrhalis) за 2 часа
Одновременная идентификация (Neisseria spp.,Haemophilus spp. и Moraxella catarrhalis), биотипирование (H. influenzae, H. parainfluenzae) и определение пенициллиназы
Быстрое получение результата (2 часа)
Простота в использовании
Упаковка содержит 10 тестов, что удобно, поскольку эти бактерии не часто встречаются в клинической практике
Идентификация Campylobacter spp. за 24 часа
Единственная система для идентификации кампилобактерий
Достоверный результат: стандартизованный метод, сочетающий референсные тесты и оптимальные условия для роста бактерий этой группы
Простота в использовании и эффективность: один этап для идентификации и прогноза чувствительности к антибиотикам (эритромицин)
Упаковка содержит 12 тестов, что удобно, поскольку кампилобактерии не часто встречаются в клинической практике
Система для научно-исследовательской работы (изучение углеводного метаболизма)
Данный стрип состоит из 49 углеводных субстратов и предназначен для:
Идентификации бактерий рода Bacillus в сочетании со средой API 50 CHB, приблизительно за 48 часов
Идентификации бактерий рода Lactobacillus в сочетании со средой API 50 CHL за 48 часов
Идентификации и биотипирования Enterobacteriaceae в сочетании со средой API 50CHE за 48 часов
Других научно-исследовательских применений, требующих изучения метаболизма углеводов
Предназначены для идентификации микроорганизмов на основе их биохимичкеских свойств
• Стрипы API используются более 40 лет
• Референсный метод идентификации, признанный “золотой стандарт” во всем мире
• Самая большая база данных: более 600 таксонов
• От 10 до 22 реакций на одном стрипе: идентификация практически всех встречающихся в клинической практике микроорганизмов в один этап
• Более 2000 публикаций
• Готовые к использованию реактивы
• Многоступенчатый контроль качества во время производства
• Простота интерпретации результатов с программным обеспечением APIWEB
• Небольшие размеры
• Как правило, для приготовления суспензии достаточно одной или нескольких стадий
Стрип изготовлен из легкого пластика, в лунках находятся сухие субстраты. Суспензия микроорганизмов вносится в лунки стрипа, и после инкубации производится учет результата по изменению цвета среды.
API 20 E®
Идентификация грамотрицательных палочек за 18-24 часа
• База данных включает практически все встречающиеся в клинической практике виды
• Референсный метод для оценки характеристик других систем идентификации (600 публикаций)
• Быстрота и простота в использовании: нужна одна колония, инструкции по заполнению стрипа указаны прямо на стрипе, стрипы запечатаны в пакеты, цвета реакций четко различимы, специальное программное обеспечение для интерпретации результатов
• Длительный срок хранения
25 стрипов
RapiD 20 E®
Экспресс-идентификация энтеробактерий за 4 часа
• База данных включает практически все встречающиеся в клинической практике виды
• Система адаптирована для критических ситуаций: быстрое назначение терапии, упрощенный режим работы лаборатории
• Достоверный результат: используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур
• Простота в использовании
• Длительный срок хранения
25 стрипов
API 20 NE
Идентификация неферментирующих грамотрицательных палочек за 24-48 часов
• Система выбора для идентификации бактерий-оппортунистов, являющихся частыми возбудителями внутрибольничных инфекций (поскольку эти бактерии становятся все более и более устойчивыми к антибиотикам, точная идентификация необходима)
• Тесты для определения ферментативной активности и способности утилизировать углеводы, адаптированные для неферментирующих бактерий; референсная система в идентификации неферментирующих бактерий
• Достоверный результат: используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур.
25 стрипов
API 10
Идентификация грамотрицательных палочек по упрощенной схеме за 18-24 часа
• Упрощенный вариант стрипа API 20 E (10 тестов вместо 20)
• Высокая надежность
• Быстрота и простота в использовании: нужна одна колония, инструкции по заполнению стрипа указаны прямо на стрипе, стрипы запечатаны в пакеты, цвета реакций четко различимы, специальное программное обеспечение для интерпретации результатов
50 стрипов
API Candida
Идентификация дрожжей, наиболее часто встречающихся в клинической практике, за 18-24 часа
• Эффективность: 12 биохимических тестов для идентификации дрожжей
• Система адаптирована к современным потребностям: идентификация 14 наиболее часто встречающихся в клинической практике видов дрожжей
• Простота в использовании: спонтанное изменение цвета реакции, цвета четко различимы, интерпретация при помощи короткого списка профилей
• Готовый к использованию продукт, не нужно дополнительных реактивов (среды для приготовления суспензии включены в набор)
10 стрипов
API 20 C AUX
Идентификация дрожжей за 18-24 часа
• Тесты для определения способности утилизировать углеводы = референсные тесты в идентификации дрожжей
• Простота в использовании: наличие положительного и отрицательного контроля для облегчения учета результата, не нужно дополнительных реактивов
• Расширенная база данных, включающая практически все виды, встречающиеся в клинической и ветеринарной практике
25 стрипов
API Staph
Идентификация стафилококков и микрококков за 18-24 часа
• Стандартные биохимические тесты и ферментационные тесты = референсные тесты в идентификации стафилококков
• Достоверный результат: используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур
• Очень простой метод: приготовление суспензии осуществляется прямо в питательной среде API Staph
25 стрипов
API 20 Strep
Идентификация стрептококков и родственных бактерий за 4 или 24 часа
• Точная идентификация до вида (что важно для эпидемиологии и антибиотикотерапии, поскольку патогенный потенциал и другие свойства различных видов могут сильно варьировать в пределах одной серологической группы)
• Простота в использовании и достоверный результат: идентификация родственных бактерий, которые иногда трудно определить в окрашенном по Граму мазке и дифференцировать от стрептококков.
25 стрипов
API 20 A®
Идентификация анаэробных бактерий за 24-48 часов
• Ферментационные тесты = референсные тесты в идентификации анаэробов
• Простота в использовании: приготовление суспензии осуществляется прямо в питательной среде API 20 A
• Многопараметрическая система для идентификации всех анаэробных бактерий, грамположительных и грамотрицательных
25 стрипов
API Coryne
Идентификация коринеформных бактерий за 24 часа
• Система выбора для идентификации бактерий-оппортунистов, являющихся частыми возбудителями внутрибольничных инфекций
• Единственная система для идентификации коринебактерий
• Простая, достоверная идентификация коринеформных бактерий, которых трудно охарактеризовать в мазке, окрашенном по Граму
• Стандартные биохимические тесты и ферментационные тесты = референсные тесты в идентификации коринебактерий
• Упаковка содержит 12 тестов, что удобно, поскольку коринебактерии не часто встречаются в клинической практике
12 тестов
API Listeria
Идентификация всех видов рода Listeria за 24 часа
• Единственная система для идентификации всех видов рода Listeria, в том числе Listeria monocytogenes, без CAMP-теста, с использованием оригинального запатентованного биохимического теста (DIM)
• Достоверный результат: в стрип включены специфические тесты для дифференциации рода Listeria от других родов со сходной морфологией; используется стандартизованная суспензия низкой плотности (0.5 единиц МакФарланда), что позволяет избежать пересева и смешанных культур
• Простота в использовании: приготовление суспензии осуществляется прямо в питательной среде
10 стрипов
API NH
Идентификация Neisseria spp. Haemophilus spp. и Moraxellacatarrhalis (Branhamella catarrhalis) за 2 часа
• Одновременная идентификация (Neisseria spp.,Haemophilus spp. и Moraxella catarrhalis), биотипирование (H. influenzae, H. parainfluenzae) и определение пенициллиназы
• Быстрое получение результата (2 часа)
• Простота в использовании
• Упаковка содержит 10 тестов, что удобно, поскольку эти бактерии не часто встречаются в клинической практике
10 стрипов
API Campy
Идентификация Campylobacter spp. за 24 часа
• Единственная система для идентификации кампилобактерий
• Достоверный результат: стандартизованный метод, сочетающий референсные тесты и оптимальные условия для роста бактерий этой группы
• Простота в использовании и эффективность: один этап для идентификации и прогноза чувствительности к антибиотикам (эритромицин)
• Упаковка содержит 12 тестов, что удобно, поскольку кампилобактерии не часто встречаются в клинической практике
12 стрипов
API 50 CH
Система для научно-исследовательской работы (изучение углеводного метаболизма)
Данный стрип состоит из 49 углеводных субстратов и предназначен для:
• Идентификации бактерий рода Bacillus в сочетании со средой API 50 CHB, приблизительно за 48 часов
• Идентификации бактерий рода Lactobacillus в сочетании со средой API 50 CHL за 48 часов
• Идентификации и биотипирования Enterobacteriaceae в сочетании со средой API 50 CHE за 48 часов
• Других научно-исследовательских применений, требующих изучения метаболизма углеводов
10 стрипов
Группа Н11, Н12, Н14, Н16, Н17,
Н21, Н24, Н25, Н26, Н27,
Н28, Н61, Н65, С42, С43
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Методы выявления и определения бактерий Listeria monocytogenes
Food products. Methods for detection and determination of Listeria monocytogenes bacteria
____________________________________________________________________
Текст Сравнения ГОСТ Р 51921-2002 с ГОСТ 32031-2012 см.по ссылке .
- Примечание изготовителя базы данных.
____________________________________________________________________
ОКС 07.100.30
67.080.20
67.100
67.120
ОКСТУ 9109
9209
9709
Дата введения 2003-07-01
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом мясной промышленности им. В.М.Горбатова РАСХН (головная организация); Государственным учреждением Научно-исследовательским институтом питания РАМН; Государственным учреждением Научно-исследовательским институтом эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН; Государственным унитарным предприятием Государственным научно-исследовательским и проектно-конструкторским институтом по развитию и эксплуатации флота; Государственным учреждением Всероссийским научно-исследовательским институтом ветеринарной вирусологии и микробиологии РАСХН
ВНЕСЕН Техническим комитетом по стандартизации ТК 226 "Мясо и мясная продукция"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 12 июля 2002 г. N 277-ст
3 Настоящий стандарт гармонизирован с международным стандартом ИСО 11290.2-98* "Микробиология продуктов питания и животных кормов. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 2. Метод подсчета" в части пп.9.1, 9.2, 9.3, 9.4.1-9.4.4, 9.5.1-9.5.3, В.4, В.5
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт http://shop.cntd.ru. - Примечание изготовителя базы данных.
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Апрель 2010 г.
1 Область применения1 Область применения
Настоящий стандарт распространяется на пищевые продукты, в том числе на продукты детского, лечебного и специализированного питания: мясо, включая мясо птицы, субпродукты и мясные продукты; рыбу, нерыбные объекты промысла и продукты, вырабатываемые из них; молоко и молочные продукты; маргарин, майонез, свежие и свежезамороженные овощи, картофель, салаты из овощей и устанавливает метод выявления и определения в них бактерий вида Listeria monocytogenes.
Метод основан на высеве определенного количества пищевого продукта в жидкую селективную питательную среду (с предварительным обогащением), последующем пересеве на агаризованные селективно-диагностические среды и культивировании посевов при оптимальных условиях. Принадлежность выявленных колоний к Listeria monocytogenes определяют по биологическим свойствам.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 3145-84 Часы механические с сигнальным устройством. Общие технические условия
ГОСТ 4288-76 * Изделия кулинарные и полуфабрикаты из рубленого мяса. Правила приемки и методы испытаний
________________
* На территории Российской Федерации в части раздела "Правила приемки" действует ГОСТ Р 52675-2006 .
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 7631-2008 Рыба, нерыбные продукты и продукция из них. Методы определения органолептических и физических показателей
ГОСТ 7702.2.0-95/ГОСТ Р 50396.0-92 Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим испытаниям
ГОСТ 9225-84 Молоко и молочные продукты. Методы микробиологического анализа*
________________
* На территории Российской Федерации действует ГОСТ Р 53430-2009 .
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9792-73 Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб
ГОСТ 9958-81 Изделия колбасные и продукты из мяса. Методы бактериологического анализа
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.8-88 Продукты пищевые. Метод определения Bacillus cereus
ГОСТ 13928-84 Молоко и сливки заготовляемые. Правила приемки, методы отбора проб и подготовка их к анализу
ГОСТ 21237-75 Мясо. Методы бактериологического анализа
ГОСТ 25706-83 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 26809-86 Молоко и молочные продукты. Правила приемки, методы отбора и подготовка проб к анализу
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования.
ГОСТ 30004.2-93 Майонезы. Правила приемки и методы испытаний
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
ГОСТ 31339-2006 Рыба, нерыбные объекты и продукция из них. Правила приемки и методы отбора проб
ГОСТ Р 51447-99 (ИСО 3100-1-91) Мясо и мясные продукты. Методы отбора проб
ГОСТ Р 51448-99 (ИСО 3100-2-88) Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований
ГОСТ Р 52179-2003 Маргарины, жиры для кулинарии, кондитерской, хлебопекарной и молочной промышленности. Правила приемки и методы контроля
СП 1.2.731-99 * Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами
_______________
* На территории Российской Федерации документ не действует. Действует СП 1.3.2322-08. здесь и далее по тексту. - Примечание изготовителя базы данных.
В настоящем стандарте применяют следующие термины с соответствующими определениями и сокращениями:
бактерии рода Listeria (далее - листерии): Грамположительные неспорообразующие короткие палочки с закругленными концами, иногда почти кокки, одиночные или в коротких цепочках (0,4-0,5х0,5-2,0 мкм), реже образуют длинные нити.
Listeria monocytogenes: Вид бактерий рода Listeria, патогенный для человека и животных, принадлежность к которому устанавливают путем дифференциации от непатогенных видов Listeria по культуральным, биохимическим и биологическим свойствам.
МПА - мясопептонный агар.
МПБ - мясопептонный бульон.
ПБЛ - питательный бульон для выделения и культивирования листерий.
ПАЛ - питательный агар для выделения листерий.
4 Аппаратура, материалы и реактивы4.1 Аппаратура, материалы и реактивы - по ГОСТ 10444.1 со следующими дополнениями:
анализатор иммунно-ферментный типа "mini VIDAS" с использованием стрипового набора YIDAS LMO;
дозаторы пипеточные по [1];
лупа по ГОСТ 25706 ;
микроскоп биологический с иммерсионной системой и увеличением 900
рН-метр модели 2696 по [2];
петля бактериологическая из платины/иридия, никеля, хрома или пластиковая диаметром 3 мм;
пипетки градуированные по ГОСТ 29227. второго класса точности;
слайды или планшеты для иммунологических реакций по [3];
стекла покровные по ГОСТ 6672 ;
стекла предметные по ГОСТ 9284 ;
термометр цифровой по [4];
часы механические сигнальные по ГОСТ 3145 ;
бактериофаг листерийный L-3A по [5];
гидролизат казеина панкреатический;
диагностикум антительный латексный для выявления листерий "Листерия-АG-тест" по [6];
система "API Listeria" для определения ферментативных свойств по [7];
стандарт мутности Макфарланда, соответствующий 1 ЕД;
сыворотка поливалентная листериозная агглютинирующая по [8];
тест-штамм Listeria monocytogenes 766;
тест-штамм Rhodococcus equi гемолитический;
тест-штамм Staphylococcus aureus гемолитический.
5 Отбор и подготовка проб5.1 Отбор и подготовку проб пищевых продуктов проводят в соответствии с ГОСТ 26668. ГОСТ 26669. а также в соответствии с нормативными и техническими документами на конкретные виды продуктов.
Масса или объем навески должны составлять (25±0,1) г (см
), (50-100 г или 50-100 см - для продуктов детского, лечебного и специализированного питания).
5.2 Отбор и подготовку проб мяса, включая мясо птицы, субпродуктов, мясных полуфабрикатов, колбасных изделий и других мясных продуктов, в том числе продуктов детского, лечебного и специализированного питания, проводят по 5.1 и ГОСТ 4288 (1.3, 2.1, 2.11.3), ГОСТ 7702.2.0/ГОСТ Р 50396.0. ГОСТ 9792. ГОСТ 9958 (3.33), ГОСТ 21237 (1.1-1.3, 3.3), ГОСТ Р 51447. ГОСТ Р 51448 .
5.3 Отбор и подготовку проб молока и молочных продуктов, в том числе продуктов детского, лечебного и специализированного питания, проводят по 5.1 и ГОСТ 9225 (1.1-1.7), ГОСТ 13928. ГОСТ 26809. [9 ].
5.4 Отбор и подготовку проб маргарина и майонеза проводят по 5.1 и ГОСТ Р 52179 (2.1), ГОСТ 30004.2 (1.2, 2.1), [10]*.
________________
* См. раздел Библиография. - Примечание изготовителя базы данных.
5.5 Отбор и подготовку проб рыбы, нерыбных объектов промысла и продуктов, вырабатываемых из них, в том числе продуктов детского, лечебного и специализированного питания проводят по 5.1 и ГОСТ 7631. ГОСТ 31339 (1.3, 4.1-4.3), [11 ] и [12]*.
________________
* См. раздел Библиография. - Примечание изготовителя базы данных.
5.6 Отбор и подготовку проб плодоовощной продукции, в том числе продуктов детского, лечебного и специализированного питания, проводят по 5.1 и [13]*.
________________
* См. раздел Библиография. - Примечание изготовителя базы данных.
6.1 Приготовление растворов
6.1.1 Пептонно-солевой раствор для приготовления разведений - по ГОСТ 26669 (1.2).
6.1.2 Растворы и реактивы для окраски по Граму - по ГОСТ 10444.1 (4.25).
6.1.3 Физиологический раствор - по ГОСТ 10444.1 (4.29).
6.1.4 Раствор с объемной долей перекиси водорода 3% - по ГОСТ 10444.1 (4.33).
6.1.5 Приготовление растворов для постановки реакции нитратредукции.
Раствор А готовят по ГОСТ 10444.8 (3.1.7).
Раствор Б готовят по ГОСТ 10444.8 (3.1.6).
Непосредственно перед постановкой реакции растворы А и Б смешивают.
6.2 Приготовление питательных сред
6.2.1 Среды для поддержания выделенных культур и культивирования бактерий рода Listeria
6.2.1.3 Триптон-соевый бульон с дрожжевым экстрактом (TSYEB) - по [14].
6.2.1.4 Триптон-соевый агар с дрожжевым экстрактом (TSYEA) - по [14].
6.2.1.5 Трипказо-соевый бульон (TSB) - по [15].
6.2.1.6 Трипказо-соевый агар (TSA) - по [15].
6.2.1.7 Состав питательных сред и способы приготовления приведены в приложении А.1.1-А.1.4.
6.2.2 Среды селективные для предварительного обогащения
6.2.2.1 ПБЛ I - по [16].
6.2.2.2 Бульон Фразера полуконцентрированный (Half Fraser broth) - по [14], [15].
6.2.2.3 Состав питательных сред и способы приготовления приведены в приложении А (А.2.1, А.2.2).
6.2.3 Среды селективные для обогащения
6.2.3.1 ПБЛ II - по [16].
6.2.3.2 Бульон Фразера (Fraser broth) - пo [14], [15].
6.2.3.3 Состав питательных сред и способы приготовления приведены в приложении А (А.3.1, А.3.2).
6.2.4 Среды селективно-диагностические
6.2.4.1 Среда ПАЛ - по [18].
6.2.4.2 Оксфордский агар (Oxford agar) - по [14], [15].
6.2.4.3 ПАЛКАМ агар (PALCAM agar) - по [14], [15], [17].
6.2.4.4 Состав питательных сред и способы приготовления приведены в приложении А (А.4.1-А.4.3).
6.2.5 Среды для изучения биологических свойств при идентификации листерий
6.2.5.1 Питательная среда ГРМ N 1 - по [19].
6.2.5.2 Кровяной агар
К 100 см растопленного и охлажденного до 45-50 °С МПА с 1% глюкозы добавляют 5-10 см стерильно взятой дефибринированной крови животных. Смесь осторожно перемешивают и разливают в чашки Петри (не более 10 см на чашку). Слой агара должен быть равномерно окрашен в красный цвет. Среду подсушивают при (37±1) °С в соответствии с ГОСТ 26670 (4.2.1) и хранят не более 2 сут при температуре (4±1) °С. Среда должна иметь рН 7,2-7,4.
Для посева используют теплые чашки.
6.2.5.3 Лецитин-агар с активированным углем и без угля
К питательной среде ГРМ N 1 перед стерилизацией добавляют 0,5% активированного угля, растертого до порошкообразного состояния.
Желток куриного яйца разводят с соблюдением правил асептики в 150 см физиологического раствора и добавляют в количестве 5% по объему к стерилизованной и охлажденной до 40-45 °С питательной среде. Разливают в чашки Петри не более 20 см на чашку и подсушивают при (37±1) °С.
Аналогично готовят агар с добавлением желтка без добавления активированного угля.
6.2.5.4 Нитратную среду готовят по ГОСТ 10444.8 (3.2.9).
6.2.5.5 Полужидкую питательную среду (Listeria motility medium) для определения подвижности листерий готовят в соответствии с приложением А.5.1.
6.2.5.6 Среды Гисса готовят по ГОСТ 10444.1 (5.29), используя в качестве углевода рамнозу, ксилозу, маннозу и маннит.
6.2.5.7 МПБ с 0,5% глюкозы готовят по ГОСТ 10444.1 (5.13), но при приготовлении добавляют 5 г глюкозы.
6.3 Среды по 6.2.2, 6.2.3, 6.2.4 готовят накануне или непосредственно перед использованием в соответствии с указанием на этикетке.
Готовые среды хранят в темноте, так как отдельные компоненты, входящие в их состав, например акрифлавин, могут окисляться на свету, образуя продукты, подавляющие рост листерий.
7 Проведение исследования7.1 Предварительное селективное обогащение
Навеску пищевого продукта массой (25±0,1) г или объемом (25±0,1) см по 5.1 вносят в 225 см одной из жидких сред для предварительного обогащения, приготовленных по 6.2.2. Содержимое встряхивают 25-кратными круговыми движениями радиусом 30 см.
Массу навески продуктов детского, лечебного или специализированного питания отбирают по 5.1. Соотношение между количеством высеваемого продукта и питательной средой должно составлять 1:9.
Посевы культивируют при температуре (30±1) °С в течение (24±2) ч.
При росте листерий на полуконцентрированном бульоне Фразера, содержащем эскулин, отмечают почернение среды за счет гидролиза гликозида эскулина до глюкозы и эскулетина. Эскулетин реагирует с ионами железа, образуя комплекс черного или оливкового цвета.
На ПБЛ I, не содержащем эскулин, почернение не происходит.
7.2 Селективное обогащение
После инкубирования продукта по 7.1 содержимое среды, независимо от наличия в ней изменений, в количестве 0,1 см пересевают в 10 см одной из жидких сред обогащения. Посевы инкубируют при температуре (37±1) °С в течение 48 ч.
На бульоне Фразера, содержащем эскулин, отмечают почернение среды, как признак возможного присутствия листерий.
На среде ПБЛ II почернение не происходит.
7.3 Выявление характерных колоний на агаризованных селективно-диагностических средах
7.3.1 Из пробирок после инкубирования по 7.2, независимо от наличия или отсутствия признаков роста, в том числе почернения, делают посев бактериологической петлей из культуральной жидкости на поверхность одной из агаризованных селективно-диагностических сред, указанных в 6.2.4. Допускается проводить пересев параллельно на поверхность двух плотных селективно-диагностических сред.
Посевной материал растирают по поверхности шпателем или распределяют петлей в виде штриха. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670 .
Посевы инкубируют при температуре (37±1) °С в течение 24-48 ч.
7.3.2 После инкубирования по 7.3.1 чашки с посевами просматривают и отмечают рост характерных колоний.
При отсутствии роста характерных колоний листерий на селективно-диагностических средах, указанных в 6.2.4, исследование прекращают и делают заключение об отсутствии Listeria monocytogenes в исследуемой пробе продукта.
На среде ПАЛ рост листерий сопровождается потреблением эскулина и почернением колоний и питательной среды. Через 24 ч инкубирования они образуют мелкие серовато-желтые колонии с черным ореолом диаметром от 1,0 до 2,0 мм. Посторонняя кокковая микрофлора образует выпуклые колонии лимонно-желтого цвета диаметром от 1,0 до 4,0 мм, окруженные слабым (или без него) покраснением питательной среды.
На ПАЛКАМ агаре (PALCAM agar) через 24 ч инкубирования листерий формируют мелкие серовато-зеленые или оливково-зеленые колонии с черным ореолом диаметром от 1,0 до 1,5 мм, иногда с черным центром. Через 48 ч колонии диаметром 1,5-2,0 мм приобретают зеленую окраску с углубленными центрами, окруженными черным ореолом. Посторонняя кокковая микрофлора образует выпуклые желтые колонии диаметром от 1,0 до 4,0 мм.
На Оксфордском агаре колонии листерий через 24 ч инкубирования - мелкие диаметром 1 мм сероватые, окруженные черным ореолом. Через 48 ч - более темные около 2 мм в диаметре с черным ореолом и углубленным центром.
При появлении сплошного роста листерий проводят пересев бактериологической петлей из зон наибольшего почернения среды штрихами на поверхность двух чашек Петри с одной из агаризованных селективно-диагностических сред, указанных в 6.2.4, для получения изолированных колоний.
Посевы инкубируют при температуре (37±1) °С в течение 24-48 ч.
7.3.3 Для определения принадлежности характерных колоний к бактериям рода Listeria отбирают отдельных колоний, выращенных на агаризованных селективно-диагностических средах по 7.3.1, и пересевают бактериологической петлей на среды: МПА с 1% глюкозы и/или триптон-соевый агар с дрожжевым экстрактом (TSYEA), трипказо-соевый агар (TSA), МПБ с 1% глюкозы и/или триптон-соевый бульон с дрожжевым экстрактом (TSYEB), трипказо-соевый бульон (TSB).
Посевы инкубируют при температуре (37±1) °С в течение 24 ч.
Получение чистой культуры проводят по ГОСТ 26670 .
На МПА с 1% глюкозы листерии имеют вид мелких сероватых полупрозрачных колоний.
На триптон-соевом агаре с дрожжевым экстрактом (TSYEA) и трипказо-соевом агаре (TSA) типичные колонии листерий от 1,0 до 2,0 мм в диаметре, выпуклые, бесцветные, непрозрачные.
На всех указанных средах вид колоний напоминает "капли росы".
Рост листерий на средах: МПБ с 1% глюкозы, триптон-соевом бульоне с дрожжевым экстрактом (TSYEB), трипказо-соевом бульоне (TSB) характеризуется равномерным помутнением среды, при встряхивании которой наблюдаются так называемые муаровые волны.
7.4 Подтверждение принадлежности выявленных колоний к бактериям рода Listeria
Для подтверждения принадлежности выделенных микроорганизмов к роду Listeria у полученных на средах культивирования чистых культур по 7.3.3 проверяют отсутствие капсул и спор, окраску по Граму, определяют присутствие каталазы (каталазную активность), подвижность бактерий при двух температурах инкубирования: (22±1) и (37±1) °С, нитратредуцирующие свойства.
7.4.1 Из посевов по 7.3.3 готовят препараты, окрашивают их по Граму по ГОСТ 30425 (приложение Г.2) и микроскопируют. Бактерии рода Listeria являются грамположительными тонкими короткими палочками, спор и капсул не образуют.
7.4.2 Каталазную активность культур определяют в соответствии с ГОСТ 30425 (приложение Г.1) по способности каталазы разлагать перекись водорода с выделением пузырьков газа.
Бактерии рода Listeria являются каталазоположительными.
7.4.3 Подвижность культур определяют при посеве уколом в среду, приготовленную по 6.2.5.5. Посевы инкубируют при двух температурах: (22±1) и (37±1) °С в течение 48 ч.
Бактерии рода Listeria подвижны при (22±1) °С, образуют характерный рост вокруг линии укола, похожий на зонтик, и неподвижны или слабоподвижны при (37±1) °С.
7.4.4 Постановку реакции нитратредукции проводят по ГОСТ 10444.8 (4.2.5)
Бактерии рода Listeria не восстанавливают нитраты до нитритов (за исключением непатогенной Listeria grayi).
7.4.5 Обнаружение в посевах грамположительных коротких тонких палочек, каталазоположительных, не восстанавливающих нитраты до нитритов, подвижных при (22±1) °С и неподвижных или слабоподвижных при (37±1) °С, указывает на принадлежность выделенных микроорганизмов к бактериям рода Listeria.
7.5 Подтверждение принадлежности выявленных колоний к виду Listeria monocytogenes
Дифференциацию выделенных культур проводят в два этапа: сначала определяют принадлежность выделенных микроорганизмов к бактериям рода Listeria, а затем подтверждают их принадлежность к виду Listeria monocytogenes.
Определение принадлежности выделенных микроорганизмов к бактериям рода Listeria проводят по 7.4.
Для подтверждения принадлежности выделенных бактерий рода Listeria к виду Listeria monocytogenes у выделенных микроорганизмов определяют ферментативные свойства (способность ферментировать углеводы на средах Гисса с применением маннита, ксилозы, маннозы и рамнозы), -гемолитическую активность (способность образовывать зоны просветления за счет растворения эритроцитов под или вокруг колоний при посеве на поверхность кровяного агара), лецитиназную активность на средах с активированным углем и без угля, а также дополнительно проводят идентификацию Listeria monocytogenes путем постановки реакции агглютинации на стекле с поливалентной сывороткой или антительным латексным диагностикумом "Листерия - АG-тест".
Допускается для быстрого определения ферментативных свойств Listeria monocytogenes применять систему биохимической идентификации "API Listeria".
Допускается ускоренная идентификация Listeria monocytogenes с применением анализатора типа "mini VIDAS", а также дополнительное использование листерийного бактериофага L-3A для идентификации.
7.5.1 Определение ферментативных свойств Listeria monocytogenes
7.5.1.1 Культуры, полученные по 7.3.3, пересевают уколом в среды Гисса по 6.2.5.6. Посевы инкубируют до 7 сут при температуре (37±1) °С, ежедневно проверяя кислото- и газообразование. Наличие ферментативной активности в отношении углеводов определяют по изменению окраски сред за счет образования кислоты и/или газа. При появлении этих признаков проводят учет результатов. Большинство бактерий рода Listeria не ферментируют маннит (за исключением Listeria grayi).
Listeria monocytogenes ферментируют маннозу и рамнозу с образованием кислоты и не ферментируют маннит и ксилозу (таблица 1).
Таблица 1 - Характеристика видов бактерий рода Listeria
7.5.1.2 Определение ферментативных свойств Listeria monocytogenes с помощью системы биохимической идентификации "API Listeria".
При этом бактериологической петлей выделяют изолированную колонию листерий, выращенную на Оксфордском агаре или ПАЛКАМ агаре (PALCAM agar) в соответствии с 7.3.2, и вносят в пробирку с 2 см дистиллированной воды для приготовления суспензии по стандарту мутности, эквивалентной 1 ЕД по шкале Макфарланда.
Приготовленную суспензию вносят пастеровской пипеткой по 0,05 см в лунки полоски системы "API Listeria", содержащие: ESC (эскулин), -MAN (маннит), DARL (D-арабитол), XYL (ксилоза), RHA (рамноза), MDG ( -метил-D-глюкоза), RIB (рибоза), С1Р(глюкоза-1-фосфат) и TAG (D-тагатоза), избегая образования пузырьков газа. Параллельно вносят пастеровской пипеткой 0,1 см суспензии в лунку DIM полоски набора системы "API Listeria" для идентификации Listeria monocytogenes от Listeria innocua.
Полоски набора, на которые нанесена суспензия, инкубируют при температуре 35-37 °С в аэробных условиях в течение 18-24 ч и визуально учитывают результаты цветообразования по степени окраски суспензии путем сравнения с данными таблицы 2.
Заключение о наличии Listeria monocytogenes делают на основании сравнения изменений цветообразования в лунках полоски системы "API Listeria" с данными таблицы 2 в разделе позитивной оценки.
Таблица 2 - Характеристика Listeria monocytogenes по изменению цветообразования в лунках системы "API Listeria"
Дифференциация
L.monocytogenes
от L.innocua
Бледно-оранжевый, бежево-розовый, бежево-серый
7.5.2 Определение -гемолитической активности
7.5.2.1 Для определения -гемолитической активности выделяют изолированную колонию листерий, полученную по 7.3.3, и высевают бактериологической петлей на поверхность кровяного агара, приготовленного с добавлением стерильной дефибринированной крови животных по 6.2.5.2. Посевы инкубируют при температуре (37±1) °С в течение 24 ч.
Чашки просматривают в проходящем свете и отмечают образование зон -гемолиза.
Listeria monocytogenes обладает -гемолитической активностью с образованием узких зон просветления среды под или вокруг колоний.
7.5.2.2 Допускается вспомогательно для подтверждения гемолитической активности использовать КАМП-тест (CAMP-test).
7.5.2.2.1 Двухсуточные культуры гемолитических штаммов Staphylococcus aureus и Rhodococcus equi высевают на кровяной агар, как показано на рисунке 1. Между вертикальными линиями Staphylococcus aureus и Rhodococcus equi, как показано на рисунке 1, засевают параллельными линиями исследуемые культуры на расстоянии друг от друга не менее 1 см и от вертикальных линий - 0,5 см.
Рисунок 1 - Схема посева при постановке КАМП-тестаи - культуры Rhodococcus equi и Staphylococcus aureus соответственно;
параллельные горизонтальные линии - исследуемые культуры
Рисунок 1 - Схема посева при постановке КАМП-теста
7.5.2.2.2 Желательно для контроля сделать посев тест-штамма Listeria monocytogenes 766 аналогично посеву исследуемых культур по 7.5.2.2.1.
7.5.2.2.3 Посевы инкубируют при температуре (37±1) °С в течение 24 ч. Отмечают изменение (расширение и просветление) зоны гемолиза в зонах, соседствующих с вертикальными штрихами стафилококка и родококка.
Listeria monocytogenes дает положительную КАМП-реакцию (расширение и просветление зоны гемолиза) около штриха Staphylococcus aureus и отрицательную (отсутствие изменений зоны гемолиза) - около штриха Rhodococcus equi.
7.5.3 Определение лецитиназной активности
7.5.3.1 Дно чашек Петри делят на несколько секторов или квадратов и исследуемые культуры, полученные по 7.3.3, высевают короткими штрихами по одной на сектор (квадрат). Засев каждой исследуемой культуры проводят параллельно на чашки, содержащие и не содержащие уголь.
Посевы инкубируют при температуре (37±1) °С в течение 48 ч.
Чашки просматривают в проходящем свете и отмечают наличие (отсутствие) лецитиназной активности на чашках, содержащих и не содержащих активированный уголь.
Listeria monocytogenes дает плотную зону помутнения шириной 3,0-6,0 мм на питательной среде с активированным углем за счет гидролиза лецитина.
Listeria monocytogenes гидролизует лецитин только в присутствии активированного угля. На среде, не содержащей активированный уголь, Listeria monocytogenes не обладает лецитиназной активностью (таблица 1).
7.5.3.2 Желательно для контроля сделать посев тест-штамма Listeria monocytogenes 766 аналогично посеву исследуемых культур по 7.5.3.1.
7.5.4 Постановка реакции агглютинации для идентификации Listeria monocytogenes
Реакцию агглютинации для идентификации Listeria monocytogenes выполняют на стекле с помощью поливалентной листериозной агглютинирующей сыворотки, содержащей антитела 0-II, V, VI, VII, IX и Н-АВ.
Предназначенную для идентификации чистую культуру, выращенную в течение 24 ч в питательном бульоне по 7.3.3 при (37±1) °С, засевают бактериологической петлей частым штрихом в две пробирки с МПА с 1% глюкозы и выдерживают в течение 24-30 ч при температуре (22±1) °С в темном месте. Культуру, выращенную на МПА с 1% глюкозы, смывают небольшим количеством физиологического раствора, чтобы получить густую взвесь (10-15 млрд. клеток в 1 см ).
Реакцию агглютинации ставят на чистых обезжиренных предметных стеклах.
На предметное стекло наносят две капли: каплю поливалентной сыворотки и каплю физиологического раствора. К обеим каплям добавляют по одной капле смыва культуры, выращенной на МПА с 1% глюкозы. Смесь тщательно и быстро перемешивают бактериологической петлей или запаянным концом пастеровской пипетки, после чего стекло плавно покачивают круговыми движениями. Одновременно ставят контрольный опыт: на предметное стекло наносят каплю поливалентной сыворотки и добавляют к ней каплю физиологического раствора.
Учет результатов реакции агглютинации проводят в течение 3 мин, отмечая появление хлопьев в капле с сывороткой. Запоздалые реакции не учитывают.
Реакцию агглютинации считают положительной при появлении хлопьев в капле с поливалентной листериозной сывороткой и отрицательной реакцией - отсутствие хлопьев в контроле.
При наличии спонтанной агглютинации реакцию агглютинации ставят повторно по указанной выше методике, но при посеве на МПА с 1% глюкозы в качестве посевного материала используют культуру, выращенную в МПБ с 1% глюкозы в течение 24 ч при температуре (22±1) °С, чтобы предотвратить повторную спонтанную агглютинацию.
7.5.5 Определение чувствительности Listeria monocytogenes к листерийному бактериофагу L-3A для идентификации.
Допускается дополнительное определение для идентификации Listeria monocytogenes по реакции чувствительности к листерийному бактериофагу L-3A.
Для определения используют агаровую культуру, выращенную по 7.3.3 при температуре (37±1) °С в течение 16-18 ч, которую засевают в МПБ с 1% глюкозы или МПБ с 0,5% глюкозы. Количество посевного материала должно быть таким, чтобы после встряхивания в пробирке с бульоном образовалась легкая опалесценция. Культуры подращивают в термостате при температуре (37±1) °С в течение 4 ч. После этого бактериальную взвесь наносят газоном на поверхность подсушенного МПА в чашках Петри. При подсушивании чашки открывают и переворачивают вверх дном. Агар, разлитый накануне, подсушивают 20-30 мин при комнатной температуре, а разлитый в день исследования - 1-1,5 ч при температуре (37±1) °С.
В одной чашке можно одновременно проводить анализ четырех культур. Для этого поверхность агара делят на четыре сектора. На каждый сектор наносят по 0,1 см исследуемой культуры и равномерно распределяют отдельным шпателем по отмеченному участку поверхности плотной питательной среды. Чашки с засеянными культурами выдерживают в термостате при температуре (37±1) °С в течение 1,0-1,5 ч.
Перед применением листерийного бактериофага L-3A содержимое ампул растворяют в пробирке, с МПБ, с 1% глюкозы в объеме, указанном на этикетке ампулы, и переносят в пробирки с соблюдением правил асептики. Растворенный бактериофаг не пригоден к использованию при наличии осадка, хлопьев или помутнения.
Неиспользованный в день исследования растворенный бактериофаг хранят в холодильнике при температуре 2-6 °С в течение 5-10 сут и применяют в дальнейшей работе после предварительной проверки на отсутствие бактериального загрязнения по [5].
Всю лабораторную посуду, в которой содержался бактериофаг, а также выбракованный бактериофаг и посевы после их учета обезвреживают кипячением не менее 30 мин.
Для исследования литического действия бактериофага на культуру листерий с целью ее идентификации на газон испытуемой культуры пастеровской пипеткой или бактериологической петлей наносят по одной капле бактериофага и отдельно каплю стерильного МПБ (контроль).
Место нанесения каждой капли отмечают карандашом по стеклу с наружной стороны чашки. Расстояние между наносимыми каплями должно быть не менее 1 см. Чашки после нанесения бактериофага и бульона оставляют при комнатной температуре (22±1) °С в затемненном месте.
Учет результатов проводят через 16-24 ч. Культуру признают Listeria monocytogenes, если в месте нанесения бактериофага образуется прозрачная зона лизиса или полусливной лизис (в виде губки). Допускается наличие единичных колоний или сплошного нежного роста вторичной культуры в зоне лизиса при интенсивном бактериальном росте на остальной поверхности агара. В месте нанесения капли стерильного бульона (контроль) зона лизиса должна отсутствовать.
7.5.6 Постановка реакции пассивной агглютинации для идентификации Listeria monocytogenes
Дополнительно для идентификации культуры, выращенной по 7.3.3, допускается использовать иммунодисперсный антительный латексный диагностикум "Листерия - АG-тест" на основе синтетических окрашенных, монодисперсных функциональных микросфер.
Принцип метода состоит в специфической иммуноагглютинации микросфер, сенсибилизированных листерийными антителами.
При постановке реакции пассивной агглютинации на слайдах учет реакции проводят в течение 3 мин при образовании в капле ярко выраженных хлопьев, свидетельствующих о положительном результате.
При постановке реакции пассивной агглютинации в лунках полистироловых планшетов учет результатов проводят визуально через 2-3 ч после постановки реакции. Положительным результатом наличия Listeria monocytogenes считают тот, если в лунке планшета агглютинат имеет форму "зонтика" или равномерно распределен на дне. Отрицательным считают результат, если агглютинат оседает на дне лунки в виде колечка диаметром 1,0-1,5 мм или пуговки. Полученные результаты сравнивают с контрольными образцами, включенными в набор.
Реакцию на слайдах и полистироловых планшетах учитывают при отрицательном результате с негативным контрольным образцом и при положительном результате с позитивным контрольным образцом, включенных в диагностикум "Листерия - АG-тест".
7.5.7 Идентификация Listeria monocytogenes с помощью иммуноферментного анализатора типа "mini VIDAS" и применением стрипового набора "VIDAS LMO".
Для ускоренной идентификации Listeria monocytogenes используют приборы иммуноферментного анализа (ИФА), в том числе типа "mini VIDAS", зарегистрированные и сертифицированные для применения в Российской Федерации как средства измерения.
Для проведения анализа 1,0 см обогащенной культуры на полуконцентрированном или концентрированном бульоне Фразера по 6.2.2.2 или 6.2.3.2 помещают в чистую стерильную пробирку и прогревают при температуре (100±1) °С в течение 10 мин. Полученный субстрат в количестве 0,5 см добавляют в незапечатанную лунку стрипа VIDAS LMO. Стрип помещают в анализатор. Ввод данных производят в соответствии с инструкцией фирмы-изготовителя. Все этапы анализа выполняются прибором автоматически.
В случае выдачи анализатором результата "Positive" делают заключение о наличии в исследуемом образце патогенных листерий. Эти результаты должны быть подтверждены исследованиями, проведенными по разделу 7 настоящего стандарта. Результаты оформляют в соответствии с разделом 8.
8 Обработка результатов
Результат оценивают по каждой пробе отдельно.
В образце констатируют присутствие Listeria monocytogenes, если из среды накопления выделены короткие грамположительные палочки, каталазоположительные, подвижные при (22±1) °С, неподвижные или слабоподвижные при (37±1) °С, гидролизирующие эскулин; ферментирующие с образованием кислоты рамнозу и маннозу, не сбраживающие маннит и ксилозу, обладающие лецитиназной активностью только в присутствии активированного угля и -гемолитической активностью.
Результаты выявления Listeria monocytogenes в определенной навеске продукта записывают: "Listeria monocytogenes обнаружены в 25 г (см ) (в 50-100 г (см ) - для продуктов детского, лечебного и специализированного питания) продукта" или "Listeria monocytogenes не обнаружены в 25 г (см ) (в 50-100 г (см ) - для продуктов детского, лечебного и специализированного питания) продукта".
9 Требования безопасности
При исследованиях пищевых продуктов на наличие Listeria monocytogenes руководствуются СП 1.2.731-99 и правилами Минздрава СССР [20 ].
Акрифлавин, хлорид лития и циклогексимид, введенные в состав микробиологических питательных сред, являются токсичными веществами. Не допускается их попадание на кожу и в глаза.
ПРИЛОЖЕНИЕ А (справочное). Состав питательных средА.1 Среды для поддержания выделенных культур и культивирования бактерий рода Listeria
А.1.1 Триптон-соевый бульон с дрожжевым экстрактом (TSYEB)*
________________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
Состав среды на 1 дм . г:
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,3±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Приготовленную среду хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.1.2 Триптон-соевый агар с дрожжевым экстрактом (TSYEA)*
________________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
Состав среды на 1 дм . г:
гидролизат казеина ферментативный
папаиновый отвар соевой муки
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,3±0,2) и стерилизуют в автоклавах при температуре (121±1) °С в течение 15 мин.
Приготовленную среду разливают в чашки Петри и хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.1.3 Трипказо-соевый бульон (TSB)*
_______________
* По прописи фирмы "BioMerieux.", Франция.
Состав среды на 1 дм . г:
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,3±0,1) и стерилизуют в автоклавах при температуре (121±1) °С в течение 15 мин.
Приготовленную среду хранят не более 4 мес в защищенном от света месте при температуре не выше 8 °С.
Допускается использовать трипказо-соевый бульон взамен триптон-соевого бульона с дрожжевым экстрактом по А.1.1.
А.1.4 Трипказо-соевый агар (TSA)*
_____________
* По прописи фирмы "BioMerieux.", Франция.
Состав среды на 1 дм . г:
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,3±0,1) и стерилизуют при температуре (121±1) °С в течение 15 мин.
Приготовленную среду разливают в чашки Петри и хранят не более 47 сут в защищенном от света месте при температуре не выше 8 °С.
Допускается использовать трипказо-соевый агар взамен триптон-соевого агара с дрожжевым экстрактом по А.1.2.
А.2 Среды селективные для предварительного обогащения
А.2.1 Питательный бульон для выделения и культивирования листерий (ПБЛ I)
Состав основы среды на 1 дм . г:
гидролизат казеина ферментативный
пептон ферментативный мясной
гидролизат автолизованных дрожжей
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,0±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Перед употреблением к 1 дм основы среды с соблюдением правил асептики добавляют 4,44 см раствора селективных компонентов. Раствор готовят следующим образом: 10 мг налидиксовой кислоты, 5 мг акрифлавина и 5 мг полимиксина В сульфата* растворяют в 10 см стерильного физиологического раствора.
_____________
* Допускается применение других веществ, обладающих аналогичными ингибиторными свойствами.
Приготовленную среду разливают в стерильные колбы по 225 см и хранят не более 2 сут в защищенном от света месте при температуре не выше 8 °С.
А.2.2 Полуконцентрированный бульон Фразера (Half Fraser broth)
А.2.2.1 Состав основы среды* на 1 дм . г:
______________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
гидролизат казеина ферментативный
пептический отвар животной ткани
цитрат аммонийного железа
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,2±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Перед употреблением к 1 дм основы среды с соблюдением правил асептики добавляют селективные компоненты: 10 мг налидиксовой кислоты и 12,5 мг акрифлавина, растворенные в 10 см стерильного раствора гидроокиси натрия концентрации 0,2 г/дм .
Приготовленную среду разливают в стерильные колбы (по 225 см ) и хранят не более 22 сут в защищенном от света месте при температуре не выше 6 °С.
А.2.2.2 Состав среды (готовая форма, 225 см )* на 1 дм . г:
_____________
* По прописи фирмы "BioMerieux.", Франция.
цитрат аммонийного железа
Среду хранят не более 6 мес в защищенном от света месте при температуре не выше 8 °С.
Допускается использовать полуконцентрированный бульон Фразера взамен ПБЛ I по А.2.1.
А.3 Среды селективные для обогащения
А.3.1 Питательный бульон для выделения и культивирования листерий (ПБЛ II)
Состав основы среды на 1 дм . г:
гидролизат казеина ферментативный
гидролизат автолизованных дрожжей
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,0±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Перед употреблением к 1 дм основы среды с соблюдением правил асептики добавляют 4,44 см раствора селективных компонентов. Раствор готовят следующим образом: 10 мг налидиксовой кислоты, 5 мг акрифлавина и 5 мг полимиксина В сульфата* растворяют в 5 см стерильного физиологического раствора.
_____________
* Допускается применение других веществ, обладающих аналогичными ингибиторными свойствами.
Приготовленную среду разливают в стерильные пробирки (по 10 см ) и хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.3.2 Бульон Фразера (Fraser broth)
А.3.2.1 Состав основы среды* на 1 дм . г:
______________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
гидролизат казеина ферментативный
пептический отвар животной ткани
цитрат аммонийного железа
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,2±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Перед употреблением к 1 дм основы среды с соблюдением правил асептики добавляют селективные компоненты: 100 мг налидиксовой кислоты и 250 мг акрифлавина, растворенные в 10 см стерильного раствора гидроокиси натрия концентрации 0,2 г/дм .
Приготовленную среду разливают в стерильные пробирки по 10 см и хранят не более 22 сут в защищенном от света месте при температуре не выше 6 °С.
А.3.2.2 Состав среды (готовая форма, 10 см )* на 1 дм . г:
______________
* По прописи фирмы "BioMerieux.", Франция.
цитрат аммонийного железа
Среду хранят не более 6 мес в защищенном от света месте при температуре не выше 8 °С.
Допускается использовать бульон Фразера взамен ПБЛ II по А.3.1.
А.4 Среды селективно-диагностические
А.4.1 Питательный агар для выделения листерий (ПАЛ)
Состав основы среды на 1 дм . г:
гидролизат казеина панкреатический
гидролизат рыбной муки панкреатический
гидролизат автолизованных дрожжей
цитрат аммонийного железа
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,0±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
К 1 дм стерильной расплавленной основы среды добавляют с соблюдением правил асептики 4,44 см раствора селективных компонентов. Раствор готовят следующим образом: 0,02 г налидиксовой кислоты, 0,01 г полимиксина В сульфата* и 0,01 г акрифлавина растворяют в 10 см стерильной дистиллированной воды и тщательно перемешивают.
______________
* Допускается применение других веществ, обладающих аналогичными ингибиторными свойствами.
Приготовленную питательную среду разливают в стерильные чашки Петри и хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.4.2 Оксфордский агар (Oxford agar)
А.4.2.1 Состав основы среды* на 1 дм . г:
_______________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
цитрат аммонийного железа
Компоненты растворяют при нагревании в 1000 см дистиллированной воды и тщательно перемешивают до полного растворения. Устанавливают рН (7,0±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
К 1 дм стерильной расплавленной основы среды добавляют с соблюдением правил асептики селективные компоненты: 0,005 г акрифлавина, 0,02 г колистина, 0,4 г циклогексимида, 0,01 г фосфомицина, 0,002 г цефотетана, растворенные в 10 см стерильной дистиллированной воды.
Приготовленную питательную среду разливают в стерильные чашки Петри и хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.4.2.2 Состав среды (готовая форма)* на 1 дм . г:
_____________
* По прописи фирмы "BioMerieux.", Франция.
цитрат аммонийного железа
Среду хранят не более 6 мес в защищенном от света месте при температуре не выше 8 °С.
Допускается использовать Оксфордский агар взамен среды ПАЛ по А.4.1.
А.4.3 ПАЛКАМ агар (PALCAM agar)
А.4.3.1 Состав основы среды* на 1 дм . г:
_______________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
цитрат аммонийного железа
Компоненты растворяют в 1000 см дистиллированной воды и тщательно перемешивают. Устанавливают рН (7,0±0,2) и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
К 1 дм стерильной расплавленной основы среды добавляют с соблюдением правил асептики селективные компоненты: 0,005 г акрифлавина, 0,01 г полимиксина В, 0,02 г цефтазидина, растворенные в 10 см стерильной дистиллированной воды.
Приготовленную питательную среду разливают в стерильные чашки Петри и хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.4.3.2 Состав среды (готовая форма)* на 1 дм . г:
______________
* По прописи фирмы "BioMerieux.", Франция.
цитрат аммонийного железа
полимиксин В сульфат
Среду хранят не более 6 мес в защищенном от света месте при температуре не выше 8 °С.
Допускается использовать ПАЛКАМ агар взамен среды ПАЛ по А.4.1.
А.5 Среда для изучения биологических свойств при идентификации листерий
А.5.1 Полужидкая питательная среда для определения подвижности листерий (Listeria motility medium)*
_______________
* По прописи фирмы "HiMedia Lab. Ltd.", Индия.
Состав среды на 1 дм . г:
гидролизат казеина ферментативный
Компоненты растворяют в 1000 см дистиллированной воды, кипятят до полного растворения среды и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Приготовленную среду хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
А.6 Требования к микробиологическим питательным средам и биологическим препаратам
Питательные среды и биологические препараты отечественного производства должны вырабатываться по нормативной и технической документации, утвержденной в установленном порядке.
Питательные среды и биологические препараты импортного производства должны иметь разрешение Министерства здравоохранения Российской Федерации на их применение, выданное на основании международных сертификатов качества ИСО 9000 или EN 29000.
ПРИЛОЖЕНИЕ Б (справочное). Библиография
[1] ТУ 64-1-33-29-81 Дозаторы пипеточные*
________________
* ТУ, упомянутые здесь и далее по тексту, не приводятся. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
[2] ТУ 4215-001-13245171-97 рН-метр модели 2696. М. ТОО "Замер", 1997
[3] ТУ 64-2-375-86 Слайды и полистироловые планшеты. Технические условия
[4] ТУ 4215-002-13245171-01 Термометр цифровой "Замер-1". М. ООО "Измерительная техника", 2001
[5] ТУ 46-20-1457-83 Набор листерийных бактериофагов сухих для идентификации листерий и постановки реакции нарастания титра фага
[6] ВФС 42-2988-97* Антительный латексный диагностикум для выделения листерий "Листерия-АG-тест". Минздрав РФ, 1997
________________
* Документ не приводится. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
[7] Регистрационное удостоверение N 97/496 Комплекс средств для определения антибиотикочувствительности и идентификации микроорганизмов. Фирма "Биомерье" ("BioMerieux"), Франция. Минздрав РФ/19.05.97
[8] ТУ 46-21-1542-85 Набор сывороток для типизации листерий. Ставропольская биофабрика, 1985
[9] МУК 4.2.577-96 Методы контроля, биологические и микробиологические факторы. Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов. Методические указания
[10] Инструкция по санитарно-бактериологическому контролю производства маргарина и майонеза на предприятиях маргариновой промышленности*. Госагропром СССР, М. 21.11.88
________________
* Документ не приводится. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
[11] Инструкция по санитарно-микробиологическому контролю производства пищевой продукции из рыбы и морских беспозвоночных N 5319-81* от 22.02.91
______________
* Вероятно ошибка оригинала. Следует читать: N 5319-91. - Примечание изготовителя базы данных.
[12] Руководство по выявлению и определению патогенных листерий в свежей, охлажденной и мороженой рыбе*. Госкомрыболовства РФ, 2000 г.
________________
* Документ не приводится. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
[13] Инструкция по микробиологическому контролю быстрозамороженной плодоовощной продукции*. МЗ СССР, М. 29.09.89
________________
* Документ не приводится. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
[14] ИСО 11290-2:1998 Микробиология продуктов питания и животных кормов. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 2. Метод подсчета
[15] Регистрационное удостоверение N 98/267 Набор реактивов для микробиологических исследований. Фирма "Биомерье" (BioMerieux"), Франция. Минздрав РФ/23.02.98
[16] ТУ 9385-670-00419779-2001 Питательный бульон для выделения и культивирования листерий (ПБЛ)
[17] Регистрационное удостоверение N 98/1589 Сухие питательные среды производства фирмы "HiMedia" (Индия), Минздрав РФ/17.12.98
[18] ТУ 9385-669-00419779-2001 Питательный агар для выделения и культивирования листерий (ПАЛ)
[19] ВФС 42-2988-97 Среда питательная ГРМ N 1 для контроля микробной загрязненности, сухая (для выращивания бактерий). Минздрав РФ, 1997
_______________________________________________________________________________
УДК 663/.664:543.9:006.354 ОКС 07.100.30 Н11 Н26 ОКСТУ 9109
67.080.20 Н12 Н27 9209
67.100 Н14 Н28 9709
67.120 Н16 Н61
Н17 Н65
Н21 С42
Н24 С43
Н25
Ключевые слова: пищевые продукты, мясо, субпродукты, мясные продукты, рыба, нерыбные объекты промысла, рыбные продукты, молоко, молочные продукты, маргарин, майонез, свежие и свежезамороженные овощи, картофель, салаты из овощей, Listeria monocytogenes, питательные среды, отбор и подготовка проб, селективное обогащение, выделение культур микроорганизмов, идентификация листерий, оценка результатов
_______________________________________________________________________________
Электронный текст документа
подготовлен АО "Кодекс" и сверен по:
официальное издание
Продукты пищевые, консервы.
Методы микробиологического анализа:
Сб. ГОСТов. - М. Стандартинформ, 2010