







 Рейтинг: 4.5/5.0 (1744 проголосовавших)
Рейтинг: 4.5/5.0 (1744 проголосовавших)Категория: Бланки/Образцы
4. Письменный контроль
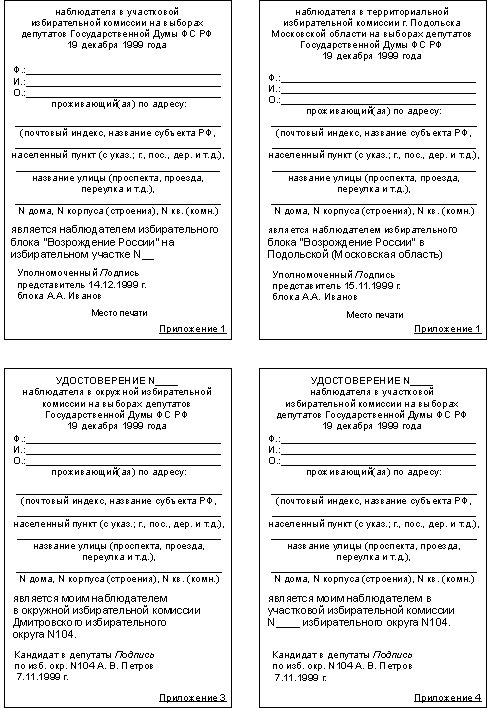
4.1. При изготовлении лекарственных форм по рецептам и требованиям лечебных учреждений заполняются паспорта письменного контроля. В паспорте должны быть указаны: дата изготовления, номер рецепта (номер больницы, название отделения), наименования взятых лекарственных веществ и их количества, число доз, подписи изготовившего, расфасовавшего и проверившего лекарственную форму. В случае изготовления лекарственной формы практикантом ставится подпись ответственного за производственную практику.
4.2. Все расчеты должны производиться до изготовления лекарственной формы и записываться на обратной стороне паспорта. Паспорт заполняется немедленно после изготовления лекарственной формы, по памяти, на латинском языке, в соответствии с последовательностью технологических операций. При заполнении паспорта на гомеопатические лекарственные формы указываются гомеопатические названия последовательно взятых лекарственных средств.
В случае использования полуфабрикатов и концентратов в паспорте указываются их состав, концентрация, взятый объем или масса. При изготовлении порошков, суппозиториев и пилюль указывается общая масса, количество и масса отдельных доз. Общая масса пилюль или суппозиториев, концентрация и объем (или масса) изотонирующего и стабилизирующего веществ, добавленных в глазные капли, растворы для инъекций и инфузий, должны быть указаны не только в паспортах, но и на рецептах.
В паспорте следует указывать формулы расчета и использованные при этом коэффициенты водопоглощения для лекарственного растительного сырья, коэффициенты увеличения объема растворов при растворении лекарственных веществ, коэффициенты замещения при изготовлении суппозиториев.
4.3. Ведение паспортов письменного контроля, если лекарственные формы изготавливаются и отпускаются одним и тем же лицом, также является обязательным. В этом случае паспорт заполняется в процессе изготовления лекарственной формы.
4.4. Паспорта письменного контроля сохраняются в аптеке в течение двух месяцев.
4.5. Изготовленные лекарственные формы, рецепты и заполненные паспорта передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных средств (далее "провизор - технолог"). Контроль заключается в проверке соответствия записей в паспорте письменного контроля прописи в рецепте, правильности произведенных расчетов. Если провизором - аналитиком проведен полный химический контроль качества лекарственного средства, то на паспорте проставляется номер анализа и подпись провизора - аналитика.
4.6. При изготовлении концентратов, полуфабрикатов, внутриаптечной заготовки и фасовки лекарственных средств все записи производятся в книгах учета лабораторных и фасовочных работ.
Тема: « Внутриаптечный контроль качества лекарственных средств»
Цель: изучение обязательных видов внутриаптечного контроля качества лекарственных препаратов.
1. Проведение приемочного контроля
2. Проведение письменного контроля
3. Проведение органолептического контроля
4. Проведение контроля при отпуске
Задание № 1. Осуществить приемочный контроль лекарственных препаратов, согласно инструкции:
1.1. Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных средств.
1.2. Приемочный контроль заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: "Описание"; "Упаковка"; "Маркировка" ; а также в проверке правильности оформления расчетных документов (счетов), наличия сертификатов соответствия производителя и других документов, подтверждающих качество лекарственных средств в соответствии с действующими нормативными документами.
1.2.1. Контроль по показателю "Описание" включает проверку внешнего вида, цвета, запаха. В случае сомнения в качестве лекарственных средств образцы направляются в территориальную контрольно - аналитическую лабораторию. Такие лекарственные средства с обозначением: "Забраковано при приемочном контроле" хранятся в аптеке изолированно от других лекарственных средств.
1.2.2. При проверке по показателю "Упаковка" особое внимание обращается на ее целостность и соответствие физико - химическим свойствам лекарственных средств .
1.2.3. При контроле по показателю "Маркировка" обращается внимание на соответствие оформления лекарственных средств действующим требованиям. На этикетке должно быть указано: предприятие-изготовитель или предприятие производившее фасовку, наименование лекарственного средства, его масса или объем, концентрация или состав, номер серии, номер анализа, срок годности, дата фасовки .
1.2.4. Особое внимание следует обращать на соответствие маркировки первичной, вторичной и групповой упаковки, наличие листовки - вкладыша на русском языке в упаковке (или отдельно в пачке на все количество готовых лекарственных средств).
1.2.5. На этикетках упаковки с лекарственными веществами, предназначенными для изготовления растворов для инъекций и инфузий, должно быть указание "Годен для инъекций". Упаковки с ядовитыми и наркотическими лекарственными средствами должны быть оформлены в соответствии с требованиями законодательства Российской Федерации и нормативных документов.
1.2.6. Лекарственное растительное сырье, поступившее от населения, проверяется по показателю "Внешние признаки " в соответствии с требованиями Государственной Фармакопеи или действующего нормативного документа, после чего направляется на анализ в территориальную контрольно - аналитическую лабораторию.
Данные проверки записать в таблицу и журнал приемочного контроля
Состав лекарственной формы или наименование лекарственного препарата
Задание №2. Осуществить письменный контроль лекарственных препаратов, согласно инструкции:
2.1. При изготовлении лекарственных форм по рецептам и требованиям лечебных организаций заполняются паспорта письменного контроля. В паспорте должны быть указаны: дата изготовления, номер рецепта (номер лечебной организации, название отделения), наименование взятых лекарственных веществ и их количества, число доз, подписи изготовившего, расфасовавшего и проверившего лекарственную форму. В случае изготовления лекарственной формы практикантом ставится подпись лица, ответственного за производственную практику.
2.2. Все расчеты должны производиться до изготовления лекарственной формы и записываться на обратной стороне паспорта. Паспорт заполняется немедленно после изготовления лекарственной формы, по памяти, на латинском языке, в соответствии с последовательностью технологических операций. При заполнении паспорта на гомеопатические лекарственные формы указываются гомеопатические названия последовательно взятых лекарственных средств. В случае использования полуфабрикатов и концентратов в паспорте указывается их состав, концентрация, взятый объем или масса. При изготовлении порошков, суппозиториев и пилюль указывается общая масса, количество и масса отдельных доз. Общая масса пилюль или суппозиториев, концентрация и объем (или масса) изотонирующего и стабилизирующего веществ, добавленных в глазные капли, растворы для инъекций и инфузий, должны быть указаны не только в паспортах, но и на рецептах. В паспорте следует указывать формулы расчета и использованные при этом коэффициенты водопоглощения для лекарственного растительного сырья, коэффициенты увеличения объема растворов при растворении лекарственных веществ, коэффициенты замещения при изготовлении суппозиториев.
2.3. Ведение паспортов письменного контроля также необходимо, если лекарственные формы изготавливаются и отпускаются одним и тем же лицом. В этом случае паспорт заполняется в процессе изготовления лекарственной формы.
2.4. Паспорта письменного контроля сохраняются в аптеке в течение двух месяцев с момента изготовления лекарственного средства.
2.5. Изготовленные лекарственные средства, рецепты и заполненные паспорта передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных средств (далее "провизор - технолог"). Контроль заключается в проверке соответствия записей в паспорте письменного контроля прописи в рецепте, правильности произведенных расчетов. Если проведен полный химический контроль качества лекарственного средства провизором - аналитиком, то на паспорте проставляется номер анализа и подпись провизора - аналитика.
2.6. При изготовлении концентратов, полуфабрикатов, внутриаптечной заготовки и фасовки лекарственных средств все записи производятся в книгах учета лабораторных и фасовочных работ.
Перевести рецепты с русского языка на латинский, заполнить паспорт письменного контроля для одного из рецептов.
Возьми: Атропина сульфата 4 миллиграмма Папаверина гидрохлорида 4 сантиграмма Сахара 2 дециграмма Смешай, пусть будет порошок. Дай таких доз числом 20. Обозначь. Способ, доза, продолжительность
Образец выполнения: Rp: Atropini sulfatis 0,0004 Papaverini hydrochloridi 0,04 Sacchari 0,2 Misce fiat pulvis Da tales doses № 20. Signa. Внутреннее. По 1 порошку, 2 раза в день.
Возьми: Сульфадимезина 8 дециграмм Анальгина 4 дециграмма Бутирола 2 грамма Смешай, чтобы были суппозитории числом 10 Дай. Обозначь. Способ, доза, продолжительность
Возьми: Кодеина фосфата 3 сантиграмма Камфоры 1 дециграмм Сахара 25 сантиграмм Смешай, чтобы получился порошок. Дай таких доз числом 10. Обозначь. Способ, доза, продолжительность
Задание №3. Осуществить органолептический контроль лекарственных препаратов, согласно инструкции:
3.1. Органолептический контроль заключается в проверке лекарственной формы (в том числе гомеопатической) по показателям: "Описание" (указывают внешние характеристики физического состояния, цвета, запаха, гигроскопичности), однородность смешения (для твердых и мягких лекарственных форм до разделения на дозы), отсутствие видимых механических включений (в жидких лекарственных формах).. На вкус лекарственные формы (для внутреннего применения) проверяются выборочно
Определение внешнего вида: помещают небольшое количество вещества тонким слоем на чашку Петри или предметное стекло и рассматривают форму кристаллов на белом фоне. Твердые субстанции могут быть крупнокристаллическими, кристаллическими. мелкокристаллическими или аморфными. Определение запаха в препарате проводят сразу после вскрытия упаковки. Для этого 0,5-2 г препарата равномерно распределяют на часовом стекле и через 15 минут определяют запах на расстоянии 4-6 см. Летучие жидкости наносят по 0,5 мл на фильтровальную бумагу и определяют запах сразу.
Цвет следует характеризовать названиями: белый. синий, зелёный. красный. оранжевый и т.д. На первом месте указывают цвет, который содержится в меньшей доле, на втором в большей - красно-коричневый т.п.) Слабо окрашенные образы называют: светло-желтый желтоватый и т.п. Запах характеризуется терминами:»без запаха», с характерным запахом», «со слабым характерным запахом»
3.2. Однородность порошков, гомеопатических тритураций, мазей, пилюль, суппозиториев проверяется в соответствии с требованиями Государственной Фармакопеи, действующих нормативных документов. Проверка осуществляется выборочно у каждого фармацевта в течение рабочего дня с учетом различных видов лекарственных форм.
3.3. Результаты органолептического контроля лекарственных форм регистрируются в журнале по прилагаемой форме.
Зарегистрировать результаты органолептического контроля :
Описание (согласно требованиям ГФ)
Причины возможного изменения
Задание №4. Осуществить контроль при отпуске лекарственных препаратов, согласно инструкции:
4.1. Данному контролю подвергаются все изготовленные в аптеках лекарственные средства (в том числе гомеопатические) при их отпуске. При этом проверяется герметичность и целостность упаковки. а также соответствие :
- упаковки лекарственных средств физико-химическим свойствам входящих в них лекарственных веществ;
- указанных в рецепте доз ядовитых, наркотических или сильнодействующих лекарственных веществ возрасту и виду больного животного;
- номера на рецепте и номера на этикетке ; фамилии владельца животного на квитанции, на этикетке и рецепте или его копии;
- копий рецептов прописям рецептов;
- оформления лекарственных средств действующим требованиям.
4.2. При отпуске особое внимание обращается на оформление соответствующими предупредительными надписями лекарственных форм, изготовляемых в аптеках для лечебных организаций: на растворы для лечебных клизм должна быть наклеена предупредительная надпись "Для клизм"; на растворы для дезинфекции - надписи "Для дезинфекции ", "Обращаться с осторожностью ", на все ветеринарные препараты - «Для животных» и др. Лекарственные средства, изготовленные в аптеках для лечебных организаций, оформляются и отпускаются в соответствии с требованиями действующих нормативных документов.
4.3. Гомеопатические лекарственные средства оформляются и отпускаются из аптек в соответствии с требованиями действующих нормативных документов.
4.4. Лицу, отпустившему лекарственное средство, необходимо поставить свою подпись на обратной стороне рецепта (требования).
Дата добавления: 2015-08-10 ; просмотров: 134 | Нарушение авторских прав
Работа по изготовлению заканчивается оформлением лицевой стороны паспорта письменного контроля. Заполнение ППК производится по памяти. Все
ингредиенты перечисляются в технологической последовательности в именительном падеже на латинском языке. В ППК указываются также все вспомогательные вещества не предусмотренные рецептурной прописью, но которые были использованы для изготовления данного препарата.
Оценка качества изготовленного препарата .
Провизор-технолог проводя оценку качества изготовленного препарата проверяет ППК (расчеты и технологию), оценивает раствор по органолептическим характеристикам (цвет, запах, вкус у детских препаратов, отсутствие механических включений), проводит физический контроль (отклонение в объеме) и химический контроль (качественные реакции на лекарственные вещества). Полный химический контроль проводится в соответствии с приказом № 214 от 1997 г.
ОСОБЫЕ СЛУЧАИ ИЗГОТОВЛЕНИЯ РАСТВОРОВ
Растворы медленнорастворимых веществ. К медленнорастворимым веществам относятся:квасцы, кислота борная, железа сульфат, меди сульфат, натрия сульфат, натрия тетраборат, магния сульфат и др. Растворение затруднено так как вещества имеют прочную кристаллическую решетку, поверхность медленно смачивается растворителем, замедляется диффузия тяжелых ионов. Для ускорения растворения таких веществ недостаточно механического перемешивания. Наиболее целесообразно использовать нагревание а для крупнокристаллических веществ (меди сульфат) измельчение в ступке с небольшим количеством растворителя.
Для растворения свинца ацетата используется свежепрокипяченная вода. К раствору для полного растворения свинца ацетата добавляют 5 капель разведенной уксусной кислоты на 100 мл раствора.
Растворы натрия гидрокарбоната . Натрия гидрокарбонат (Natrii hydrocarbonas) при нагревании и сильном механическом перемешивании разлагается с образованием натрия карбоната, который не является лекарственным вещесвтом, и углекислого газа:
Натрия гидрокарбонат следует растворять методом настаивания или осторожного помешивания стеклянной палочкой, без взбалтывания !
Растворы кальция глюконата . Кальция глюконат (Calcii gluconas) растворим в воде комнатной температуры 1:50. При нагревании он может образовывать устойчивые пересыщенные растворы. Для очистки раствора кальция глюконата в раствор добавляют активированный уголь в количестве 3-5% от массы лекарственного вещества.
Rp. Sol. Calcii gluconatis 10% - 200,0
D. S. По 1 столовой ложке 3 раза в день.
Выписана жидкая лекарственная форма - истинный раствор. Кальция глюконат является веществом общего списка, проверку доз не производим. Раствор выписан в терапевтической концентрации. Проверяем, не завышен ли предел растворимости кальция глюконата. По таблице растворимости (справочное пособие) находим растворимость кальция глюконата – 1:50. Это означает, что 1,0 кальция глюконата растворим в 50 мл воды, а
20,0 растворятся в Х мл воды Х = 1000 мл
В кипящей воде кальция глюконат растворим 1:5, т.е. для растворения 20 г потребуется 100 мл кипящей воды. Завышен предел растворимости в воде комнатной температуры, но учитывая способность кальция глюконата при нагревании образовывать устойчивые пересыщенные растворы лекарственную форму можно готовить. Раствор фильтруем через бумажный фильтр, так как марлевые салфетки и ватные тампоны не обеспечат полного освобождения от активированного угля. Делаем расчеты на обратной стороне ППК.
Так как Cмах меньше концентрации, выписанной в рецепте (4% <10%), значит при расчете растворителя учитываем объем, занимаемый кальция глюконатом при растворении с учетом КУО = 0,5.
Vводы = 200,0 – (20 х 0,5) = 190 мл
Количество активированного угля 5% от количества кальция глюконата, то есть от 20,0: 20,0 – 100 %
Технология лекарственного препарата. Оценка качества. Оформление к отпуску. Цилиндром отмериваем 190 мл воды, переносим в термостойкую подставку. На ручных весах отвешиваем 20,0 кальция глюконата, 1,0 активированного угля (карболена). Подставку прикрываем стеклом и кипятим на слабом огне в течение 10 минут, несколько раз перемешивая содержимое колбы. Полученный раствор в горячем виде фильтруем через бумажный фильтр в мерный цилиндр. В случае необходимости объем раствора доводим до 200 мл водой очищенной. Раствор переливаем в отпускной флакон, герметично укупориваем и оформляем к отпуску. Основная этикетка «ВНУТРЕННЕЕ» с указанием способа применения. Срок годности 10 суток в соответствии с приказом 214 от 1997 г.
Оценку качества проводим органолептически: бесцветная прозрачная жидкость без запаха. Отклонения в объеме могут быть в пределах (196 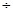 204) мл (2% в соответствии с требованиями приказа 305 от 1997 г.)
204) мл (2% в соответствии с требованиями приказа 305 от 1997 г.)
Оформляем лицевую сторону ППК:
Aqua purificata 190,0
Calcii gluconas 20.0
Carbo activatus 1,0
Растворы ртути дихлорида (сулемы). Ртути дихлорид (Hydrargyri dichloridum) относится к особо ядовитым веществам. Храниться в отдельном запирающемся отделении шкафа для хранения ядовитых и наркотических веществ. Растворы ртути дихлорида используются для дезинфекции. Отпускаются из аптек только медперсоналу. Для идентификации растворы подкрашивают эозином или фуксином, о чем следует сделать пометку на этикетке.
Ртути дихлорид медленно растворим в воде комнатной температуры (1:18,5). Растворы сулемы обладают кислой реакцией, поэтому готовят их с добавлением равного количества натрия хлорида, который уменьшая гидролиз ртути дихлорида смещает рН среды в нейтральную сторону. Такие растворы более стабильны в процессе хранения, так как препятствуют выделению в осадок основных солей HgO· HgCl₂. Изготовленный раствор отпускают в опечатанном виде с этикеткой, на которой указано на русском или местном языке название препарата, его концентрация, назначение, чем подкрашен раствор и дополнительной этикеткой «Осторожно! Яд! Сулема!». Хранится раствор со всеми мерами предосторожности, принятыми для хранения ядовитых веществ.
Растворы ртути дийодида. Ртути дийодид (Hydrargyri diyodidum) относится к ядовитым веществам, поэтому работа с ним требует особых мер предосторожности. Ртути дийодид очень мало растворим в воде. Для получения водных растворов используют его способность образовывать водорастворимые комплексы с натрия или калия йодидом. 2 г калия (натрия) йодида требуется для растворения 0,1 ртути дийодида. Изготовление проводят в подставке. В небольшом количестве воды растворяют калия йодид (его растворимость 1:0,75), в полученном растворе растворяют ртути дийодид, добавляют оставшееся количество воды и полученный раствор фильтруют в отпускной флакон. Флакон укупоривают, оформляют к отпуску и опечатывают.
Растворы осарсола. Осарсол (Osarsolum) очень мало растворим в воде, но растворим в растворах едких щелочей, аммиака, гидрокарбоната натрия. Поэтому для улучшения его растворения в воду добавляют эквимолярное количество натрия гидрокарбоната:
1 моль осарсола – 1 моль натрия гидрокарбоната
М.м. осарсола 275,09 - М.м. натрия гидрокарбоната 84,01, следовательно, 275,09 осарсола – 84,01 натрия гидрокарбоната
для 1,0 - Х натрия гидрокарбоната Х= 0,3
т.е. на 1 г осарсола требуется добавление 0,3 г натрия гидрокарбоната. чтобы добиться полного растворения осарсола. Осарсол относится в веществам списка А.В ассистентской комнате хранится в шкафу для хранения ядовитых и наркотических веществ и отвешивается на специальных весах. Так как осарсол находится на предметно-количественном учёте, списание делают на обороте рецепта при получении осарсола у провизора-технолога. Рецепт остается в аптеке, больному взамен рецепта выдается сигнатура. Лекарственная форма опечатывается и до отпуска больному хранится в закрывающемся шкафу.
Растворы фенола. Фенол чистый (кислота карболовая кристаллическая) Phenolum purum (ГФ 1Х) представляет собой бесцветные, длинные игольчатые
кристаллы или бесцветную кристаллическую массу своеобразного запаха. Растворим в 20 частях воды, легко растворим в спирте, глицерине и жирных маслах. При попадании на кожу и слизистые образует долго не заживающие язвы. В связи с этим при работе с фенолом требуется строгое соблюдение техники безопасности: работа в защитных очках и резиновых перчатках. Хранится фенол в шкафу «Пахучие и красящие» и отвешивается на специальных весочках. Для изготовления водных и глицериновых растворов пользуются фенолом жидким Phenolum purum liquefactum (кислота карболовая жидкая). Его готовят следующим образом: к 100 частям кристаллического фенола, расплавленного на водяной бане, прибавляют 10 частей воды и хорошо перемешивают. По внешнему виду фенол жидкий представляет собой бесцветную или розоватую маслянистую жидкость со своеобразным запахом. При замене в рецепте кристаллического фенола фенолом жидким количество последнего увеличивают на 10%. Дозируют фенол жидкий каплями с помощью предварительно прокалиброванной пипетки.
При изготовлении водных и глицериновых растворов используют фенол жидкий. При изготовлении масляных растворов только фенол кристаллический во избежание ожёгов.
Rp. Sol. Phenoli 1% - 200,0
D.S. Для дезинфекции инструментов.
Выписана жидкая лекарственная форма – истинный раствор. Растворитель не указан, следовательно, используем воду очищенную. Водные растворы фенола готовят с использованием фенола жидкого, которого следует взять на 10% больше, так как он содержит 10% воды. Делаем расчеты:
Фенола кристаллического 1% => 1,0 – 100 мл
Х - 200 мл Х = 2,0
Фенола жидкого на 10% больше, то есть
Mфенола жид. = 2,0 + 0,2 = 2,2
Предположим, что при калибровке пипетки установлено соотношение:
1,0 фенола жидкого – 22 капли
Изготовление ведем в отпускном флаконе. Отмериваем 200 мл воды и откапываем 48 капель фенола жидкого. Раствор перемешиваем, герметично укупориваем. Оформляем к отпуску: основная этикетка «Наружное». На этикетке указываем наименование раствора, его концентрацию и назначение раствора.
На растворы фенола в концентрации 5% и выше наклеивается дополнительная этикетка “Осторожно! Яд!”
Растворы фенола отпускают только медперсоналу.
Растворы йода . Йод (Iodum) серовато-черные с металлическим блеском пластинки или сростки кристаллов характерного запаха. Летуч при обыкновенной
температуре, при нагревании возгоняется, образуя фиолетовые пары. Растворим в воде 1:5000. В медицинской практике используются водные растворы с концентрацией йода 1% и выше. Их получают используя способность йода образовывать водорастворимые комплексы с калия йодидом. Если калия иодид в прописи не указан, то его берут в два раза больше, чем прописано йода. Чаще всего используются водные растворы Люголя.
Раствор Люголя для внутреннего применения (5%):
Йода кристаллического 1,0
Калия йодида 2,0
Воды очищенной до 20 мл
Изготовление раствора проводят в отпускном флаконе. Отвешивают 2 г калия йодида и переносят в отпускной флакон. Так как растворимость калия йодида в воде 1:0,75, значит для растворения 2 г потребуется 1,5 мл воды (30 капель). Сухих веществ более 3%, поэтому Vводы = 20 – (1,0х0,23 + 2,0х0,25) = 19,27 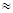 19,3 мл. В отпускной флакон из отмеренного объема (19,3 мл) откапываем 30 капель воды и растворяем калия иодид. На кружок пергаментной бумаги быстро отвешиваем 1,0 йода, переносим в отпускной флакон и растворяем в концентрированном растворе калия иодида. В случае необходимости раствор процеживаем через стеклянный фильтр №1 или №2 или через промытый горячей водой ватный тампон.
19,3 мл. В отпускной флакон из отмеренного объема (19,3 мл) откапываем 30 капель воды и растворяем калия иодид. На кружок пергаментной бумаги быстро отвешиваем 1,0 йода, переносим в отпускной флакон и растворяем в концентрированном растворе калия иодида. В случае необходимости раствор процеживаем через стеклянный фильтр №1 или №2 или через промытый горячей водой ватный тампон.
Раствор Люголя для наружного применения (1%):
Йода кристаллического 1,0
Калия йодида 2,0
Воды очищенной до 100 мл
Технология изготовления аналогичная раствору Люголя для внутреннего применения. Разница будет в объеме растворителя, используемого для изготовления раствора. Так как концентрация сухих веществ 3%, учитываем изменение объема при растворении йода и калия йодида:
Отпускают растворы йода во флаконах темного стекла. Укупоривают полиэтиленовыми пробками. Корковые пробки йод разрушает даже при
кратковременном контакте. Резиновые пробки разрушает при длительном хранении растворов.
Растворы фенобарбитала . Фенобарбитал (Phenobarbitalum) белый кристаллический порошок без запаха, слабо горького вкуса. Очень мало растворим в воде (1:1100), легко растворим в 95% спирте и растворах щелочей.
Учитывая растворимость фенобарбитала возможны три варианта изготовления его растворов:
· если концентрация фенобарбитала в растворе менее 0,1%. то фенобарбитал растворяют при нагревании в рассчитанном объеме воды;
· если в прописи есть настойки с концентрацией спирта не менее 70 о. то фенобарбитал растворяют в настойках и полученный спиртовый раствор добавляют уже в отпускной флакон;
· если концентрация фенобарбитала в растворе более 0,1% и в прописи отсутствуют спиртовые препараты, то фенобарбитал растворяют в растворе натрия гидрокарбоната (используют способность фенобарбитала растворяться в растворах щелочей). Натрия гидрокарбонат добавляют в эквимолярном количестве:
1 моль фенобарбитала – 1 моль натрия гидрокарбоната
М.м. фенобарбитала 232,24 - М.м. натрия гидрокарбоната 84,01
Следовательно, 232,24 фенобарбитала – 84,01натрия гидрокарбоната
т.е. на 1 г фенобарбитала добавляют 0,4 г натрия гидрокарбоната.
Rp. Phenobarbitali 0,2
Natrii bromidi 2,0
Aquae purificatae 200,0
Signa. По 1 столовой ложке 2 раза в день.
Концентрация фенобарбитала в растворе 0,1%, так как
0,2 фенобарбитала содержатся в 200 мл раствора
В прописи нет настоек и других спиртовых растворов. Для растворения 0,2 фенобарбитала потребуется 220 мл воды:
для растворения 1,0 фенобарбитала – 1100 мл воды
0,2 - Х мл Х = 220 мл
Это меньше 200 мл воды, выписанной в рецепте, следовательно, фенобарбитал полностью не растворится! Растворы с осадком сильнодействующих и ядовитых веществ отпускать нельзя. Поэтому для растворения фенобарбитала будем использовать натрия гидрокарбонат. Если для растворения 1,0 фенобарбитала требуется 0,4 натрия гидрокарбоната, то для растворения 0,2 фенобарбитала потребуется 0,08 натрия гидрокарбоната. Концентрация лекарственных веществ по рецепту составляет 1,2%:
Х - 100 мл Х = 1,2%
Это. меньше 3%, поэтому объем растворителя берем столько, сколько указано в рецептурной прописи. В подставку отмериваем 200 мл воды, растворяем 0,08 натрия гидрокарбоната и 0,2 фенобарбитала. После полного растворения веществ раствор процеживаем в отпускной флакон, герметично укупориваем и оформляем к отпуску.
Растворы легкоокисляющихся веществ . К легкоокисляющимся веществам относятся серебра нитрат (Argenti nitras) и калия перманганат (Kalii permanganas). В присутствии органических веществ они легко разлагаются, при этом растворы серебра нитрата чернеют за счет выпадения металлического серебра, а растворы калия перманганата буреют за счет выделения двуокиси марганца. При изготовлении растворов необходимо соблюдать следующие правила:
- для растворения веществ используют свежеприготовленную и профильтрованную воду очищенную;
- растворы фильтруют через стеклянные фильтры; бумажные обеззоленные фильтры или ватные тампоны, предварительно промытые горячей водой.
Серебра нитрат является веществом списка А. Его растворы отпускают во флаконах темного стекла в опечатанном виде с дополнительной этикеткой «Обращаться осторожно». Растворы в концентрации более 2% отпускаются только в руки медперсонала (так как обладают сильным прижигающим действием).
Калия перманганат медленно растворим в холодной воде (1:18) и легко растворим в кипящей воде (1:3,5). Если растворы калия перманганата выписаны в концентрации менее 1%, растворы можно готовить в отпускном флаконе, используя для растворения горячую свежеполученную и профильтрованную воду. Если растворы выписаны в концентрации более 1%, изготовление проводят в ступке методом «взмучивания»: калия перманганат помещают в ступку и измельчают с горячей водой (на 1г вещества 0,5 мл воды), затем добавляют еще воду и перемешивают. Надосадочную жидкость сливают в отпускной флакон. Оставшийся на дне ступки осадок вновь измельчают, добавляют воду, перемешивают и вновь сливают жидкость с осадка. Операцию повторяют до тех пор, пока не будет измельчен и растворен весь калия перманганат и использован весь объем растворителя. Растворы калия перманганата отпускают во флаконах темного стекля во избежание активации процесса разложения.
Растворы фурацилина . Фурацилин является красящим веществом. Хранится в шкафу «Пахучие и красящие». Отвешивается на весах для красящих веществ. Его растворимость в воде 1:4200, поэтому для ускорения растворения используют нагревание. В медицинской практике используются растворы фурацилина в концентрации 1:5000, что соответствует 0,02% раствору. Растворы фурацилина предназначенные для полостных промываний (мочевой пузырь, гайморовы
пазухи), глазные капли и примочки готовят на изотоническом (0,9%) растворе натрия хлорида.
Rp: Solutionis Furacillini 1:5000 - 250,0
Da. Signa. Для полоскания горла.
2. Рассчитываем количество фурацилина, необходимое для приготовления раствора:
1,0 фурацилина требуется на 5000 мл раствора
Х фурацилина на 250 мл раствора
В термостойкую колбу отмериваем 250 мл воды очищенной. На специальных весочках для красящих веществ (ВР-1) отвешиваем 0,05 фурацилина и переносим в колбу. Колбу закрываем пергаментом или часовым стеклом и нагреваем до полного растворения фурацилина. Полученный раствор фильтруем через марлевую салфетку в отпускной флакон и оформляем к отпуску. Этикетка «Наружное». Оформляем ППК.
Дата ППК № рецепта
Aqua purificata 250,0
Растворы рибофлавина и этакридина лактата . Рибофлавин и этакридина лактат являются красящими веществами. В ассистентской комнате хранятся в шкафу «Пахучие и красящие», отвешиваются на специальных весах. Растворимость в горячей воде рибофлавина 1:5000, а этакридина лактата 1:25. Для получения растворов используют фактор нагревания. Технология растворов аналогична растворам фурацилина.
© studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам
министерство сельского хозяйства
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«КУРСКАЯ ГОСУДАРСТВЕННАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ имени профессора И.И.Иванова»
Факультет ветеринарной медицины
Кафедра эпизоотологии, радиобиологии и фармакологии
к лабораторным занятиям по дисциплине
студента ___ курса группы________
(Фамилия, Имя, Отчество)
Лабораторное занятие №1
Тема: « Внутриаптечный контроль качества лекарственных средств»
Цель: изучение обязательных видов внутриаптечного контроля качества лекарственных препаратов.
1. Проведение приемочного контроля
2. Проведение письменного контроля
3. Проведение органолептического контроля
4. Проведение контроля при отпуске
Задание № 1. Осуществить приемочный контроль лекарственных препаратов, согласно инструкции:
1.1. Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных средств.
1.2. Приемочный контроль заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: "Описание"; "Упаковка"; "Маркировка" ; а также в проверке правильности оформления расчетных документов (счетов), наличия сертификатов соответствия производителя и других документов, подтверждающих качество лекарственных средств в соответствии с действующими нормативными документами.
1.2.1. Контроль по показателю "Описание" включает проверку внешнего вида, цвета, запаха. В случае сомнения в качестве лекарственных средств образцы направляются в территориальную контрольно - аналитическую лабораторию. Такие лекарственные средства с обозначением: "Забраковано при приемочном контроле" хранятся в аптеке изолированно от других лекарственных средств.
1.2.2. При проверке по показателю "Упаковка" особое внимание обращается на ее целостность и соответствие физико - химическим свойствам лекарственных средств .
1.2.3. При контроле по показателю "Маркировка" обращается внимание на соответствие оформления лекарственных средств действующим требованиям. На этикетке должно быть указано: предприятие-изготовитель или предприятие производившее фасовку, наименование лекарственного средства, его масса или объем, концентрация или состав, номер серии, номер анализа, срок годности, дата фасовки .
1.2.4. Особое внимание следует обращать на соответствие маркировки первичной, вторичной и групповой упаковки, наличие листовки - вкладыша на русском языке в упаковке (или отдельно в пачке на все количество готовых лекарственных средств).
1.2.5. На этикетках упаковки с лекарственными веществами, предназначенными для изготовления растворов для инъекций и инфузий, должно быть указание "Годен для инъекций". Упаковки с ядовитыми и наркотическими лекарственными средствами должны быть оформлены в соответствии с требованиями законодательства Российской Федерации и нормативных документов.
1.2.6. Лекарственное растительное сырье, поступившее от населения, проверяется по показателю "Внешние признаки " в соответствии с требованиями Государственной Фармакопеи или действующего нормативного документа, после чего направляется на анализ в территориальную контрольно - аналитическую лабораторию.
Данные проверки записать в таблицу и журнал приемочного контроля
Состав лекарственной формы или наименование лекарственного препарата
Задание №2. Осуществить письменный контроль лекарственных препаратов, согласно инструкции:
2.1. При изготовлении лекарственных форм по рецептам и требованиям лечебных организаций заполняются паспорта письменного контроля. В паспорте должны быть указаны: дата изготовления, номер рецепта (номер лечебной организации, название отделения), наименование взятых лекарственных веществ и их количества, число доз, подписи изготовившего, расфасовавшего и проверившего лекарственную форму. В случае изготовления лекарственной формы практикантом ставится подпись лица, ответственного за производственную практику.
2.2. Все расчеты должны производиться до изготовления лекарственной формы и записываться на обратной стороне паспорта. Паспорт заполняется немедленно после изготовления лекарственной формы, по памяти, на латинском языке, в соответствии с последовательностью технологических операций. При заполнении паспорта на гомеопатические лекарственные формы указываются гомеопатические названия последовательно взятых лекарственных средств. В случае использования полуфабрикатов и концентратов в паспорте указывается их состав, концентрация, взятый объем или масса. При изготовлении порошков, суппозиториев и пилюль указывается общая масса, количество и масса отдельных доз. Общая масса пилюль или суппозиториев, концентрация и объем (или масса) изотонирующего и стабилизирующего веществ, добавленных в глазные капли, растворы для инъекций и инфузий, должны быть указаны не только в паспортах, но и на рецептах. В паспорте следует указывать формулы расчета и использованные при этом коэффициенты водопоглощения для лекарственного растительного сырья, коэффициенты увеличения объема растворов при растворении лекарственных веществ, коэффициенты замещения при изготовлении суппозиториев.
2.3. Ведение паспортов письменного контроля также необходимо, если лекарственные формы изготавливаются и отпускаются одним и тем же лицом. В этом случае паспорт заполняется в процессе изготовления лекарственной формы.
2.4. Паспорта письменного контроля сохраняются в аптеке в течение двух месяцев с момента изготовления лекарственного средства.
2.5. Изготовленные лекарственные средства, рецепты и заполненные паспорта передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных средств (далее "провизор - технолог"). Контроль заключается в проверке соответствия записей в паспорте письменного контроля прописи в рецепте, правильности произведенных расчетов. Если проведен полный химический контроль качества лекарственного средства провизором - аналитиком, то на паспорте проставляется номер анализа и подпись провизора - аналитика.
2.6. При изготовлении концентратов, полуфабрикатов, внутриаптечной заготовки и фасовки лекарственных средств все записи производятся в книгах учета лабораторных и фасовочных работ.
Перевести рецепты с русского языка на латинский, заполнить паспорт письменного контроля для одного из рецептов.
Возьми: Атропина сульфата 4 миллиграмма
Папаверина гидрохлорида 4 сантиграмма
Сахара 2 дециграмма
Смешай, пусть будет порошок.
Дай таких доз числом 20.
Обозначь. Способ, доза, продолжительность
Задание №3. Осуществить органолептический контроль лекарственных препаратов, согласно инструкции:
3.1. Органолептический контроль заключается в проверке лекарственной формы (в том числе гомеопатической) по показателям: "Описание" (указывают внешние характеристики физического состояния, цвета, запаха, гигроскопичности), однородность смешения (для твердых и мягких лекарственных форм до разделения на дозы), отсутствие видимых механических включений (в жидких лекарственных формах).. На вкус лекарственные формы (для внутреннего применения) проверяются выборочно
Определение внешнего вида: помещают небольшое количество вещества тонким слоем на чашку Петри или предметное стекло и рассматривают форму кристаллов на белом фоне. Твердые субстанции могут быть крупнокристаллическими, кристаллическими. мелкокристаллическими или аморфными. Определение запаха в препарате проводят сразу после вскрытия упаковки. Для этого 0,5-2 г препарата равномерно распределяют на часовом стекле и через 15 минут определяют запах на расстоянии 4-6 см. Летучие жидкости наносят по 0,5 мл на фильтровальную бумагу и определяют запах сразу.
Цвет следует характеризовать названиями: белый. синий, зелёный. красный. оранжевый и т.д. На первом месте указывают цвет, который содержится в меньшей доле, на втором в большей - красно-коричневый т.п.) Слабо окрашенные образы называют: светло-желтый желтоватый и т.п. Запах характеризуется терминами:»без запаха», с характерным запахом», «со слабым характерным запахом»
3.2. Однородность порошков, гомеопатических тритураций, мазей, пилюль, суппозиториев проверяется в соответствии с требованиями Государственной Фармакопеи, действующих нормативных документов. Проверка осуществляется выборочно у каждого фармацевта в течение рабочего дня с учетом различных видов лекарственных форм.
3.3. Результаты органолептического контроля лекарственных форм регистрируются в журнале по прилагаемой форме.
Зарегистрировать результаты органолептического контроля :
(согласно требованиям ГФ)
Причины возможного изменения
Задание №4. Осуществить контроль при отпуске лекарственных препаратов, согласно инструкции:
4.1. Данному контролю подвергаются все изготовленные в аптеках лекарственные средства (в том числе гомеопатические) при их отпуске. При этом проверяется герметичность и целостность упаковки. а также соответствие :
- упаковки лекарственных средств физико-химическим свойствам входящих в них лекарственных веществ;
- указанных в рецепте доз ядовитых, наркотических или сильнодействующих лекарственных веществ возрасту и виду больного животного;
- номера на рецепте и номера на этикетке ; фамилии владельца животного на квитанции, на этикетке и рецепте или его копии;
- копий рецептов прописям рецептов;
- оформления лекарственных средств действующим требованиям.
4.2. При отпуске особое внимание обращается на оформление соответствующими предупредительными надписями лекарственных форм, изготовляемых в аптеках для лечебных организаций: на растворы для лечебных клизм должна быть наклеена предупредительная надпись "Для клизм"; на растворы для дезинфекции - надписи "Для дезинфекции ", "Обращаться с осторожностью ", на все ветеринарные препараты - «Для животных» и др. Лекарственные средства, изготовленные в аптеках для лечебных организаций, оформляются и отпускаются в соответствии с требованиями действующих нормативных документов.
4.3. Гомеопатические лекарственные средства оформляются и отпускаются из аптек в соответствии с требованиями действующих нормативных документов.
4.4. Лицу, отпустившему лекарственное средство, необходимо поставить свою подпись на обратной стороне рецепта (требования).
Лабораторное занятие №2
Тема: « Определение растворимости лекарственных веществ»
Цель:изучение растворимости лекарственных препаратов и установление соотношения растворителя и растворимого вещества в лекарственных формах.
1. Установление растворимости в соответствии с условными терминами Государственной Фармакопеи Российской Федерации;
2. Установление конкретного соотношения препарата и растворителя.
3. Установление растворимости медленно растворимых препаратов.
Задание №1.Установите растворимость препаратов в соответствии с условнымитерминами
Подберите два препарата, различающихся по растворимости, из указанных в таблице 1. Препараты отвесьте на аптечных весах с таким расчетом, чтобы на установление их растворимости воды расходовалось не более 100 мл, а органических растворителей не более 10—20 мл.
Отвешенную массу предварительно растертого в порошок препарата внесите в отмеренный объем растворителя, соответствующий минимальному его объему, согласно таблице 2, непрерывно встряхивают в течение 10 минут
Затем добавьте растворитель до максимального его объема, при котором в растворе невооруженным глазом не обнаруживаются частицы препарата. Процесс растворения осуществляйте при температуре не ниже 20° С. Полученные сведения о растворимости оформите в виде таблицы 3, пользуясь сокращенными обозначениями условных терминов (табл. 2).
Таблица 1. Растворимость некоторых лекарственных препаратов
(в мл на 1,0 г препарата)
Заключение о соответствии растворимости испытуемых препаратов требованиям соответствующей статьи ГФ: _____________________________
Задание №2. Установите конкретные соотношения препарата и растворителя.
Подберите лекарственный препарат, из указанных в таблице 4. Для этого рассчитайте массу, необходимую для того, чтобы растворителя расходовалось в пределах 10—30 мл. Взвешенную на ручных весах массу препарата растворите в отмеренном объеме растворителя в соответствии с данными таблицы 4. Результаты запишите в таблицу 5.
Таблица4: Соотношения лекарственного препарата и растворителя
Объем растворителя, необходимый для растворения
1,0 г лекарственного вещества, мл