





2007/16/1_23.png)



 Рейтинг: 4.8/5.0 (1746 проголосовавших)
Рейтинг: 4.8/5.0 (1746 проголосовавших)Категория: Руководства
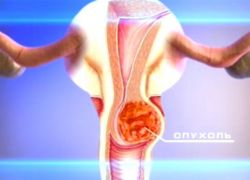
Многолетние исследования онкологов доказали, что основным фактором, провоцирующим развитие рака шейки матки является человеческий папилломавирус, или ВПЧ. Присутствие в организме канцерогенных штаммов этого вируса под номерами 16 и 18 рано или поздно приводит к диспластическим изменениям в шейке, которые способны переродиться в злокачественное новообразование. Дополнительными провокаторами развития рака шейки матки являются:
Исходя из вышеперечисленных причин, увеличивающих риск развития онкологии женской сферы, можно определить направления антираковой профилактики у девушек и женщин.
Прежде всего она направлена на предотвращение заражения вирусом папилломы человека.
Второе направление профилактики шеечного рака: общее укрепление организма и его защитных сил. Сюда можно отнести такие меры, как здоровый образ жизни, правильное питание, искоренение вредных привычек, борьба с курением, в том числе пассивным. Необходимо санировать все очаги хронических инфекций в организме и укреплять иммунитет.

Третье направление – это регулярное и своевременное посещение гинеколога. При помощи визуального осмотра, а также дополнительных видов исследований (мазка на цитологию, кольпоскопии. биопсии, анализа ПЦР и других) гинеколог может обнаружить изменения в эпителиальных тканях шейки матки и провести соответствующее лечение. Раннее выявление предраковых состояний позволяет предупредить их перерождение в онкопатологию.
Противораковые скрининги необходимо проходить как минимум раз в три года с началом половой жизни. А при налчии гинекологических заболеваний и факторов риска – не реже, чем раз в год.
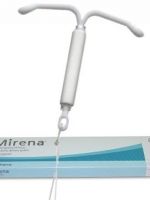
Успех применения спирали Мирена при лечении эндометриоза связан с терапевтическим эффектом выделения малых доз гормонов, подавляющих патологическое разрастание эндометрия. Как происходит процесс лечения внутри матки?

Диагноз ретроцервикальный эндометриоз не обходит стороной многих женщин. Как не упустить болезнь, какие стадии недуга бывают, и какие варианты лечения эндометриоза возможны – ответы на эти вопросы вы найдете в данной статье.
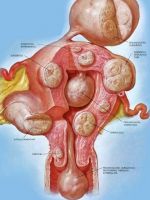
Узлы миомы могут располагаться в матке в самых разных местах. А в зависимости от локализации, и ведут они себя по-разному. Чем отличается интрамуральная миома матки от других подобных опухолей?

По своему течению и симптоматике правосторонний аднексит ничем не отличается от левостороннего. Но у него есть одна особенность – под воспаление правого придатка может замаскироваться аппендицит.
«Профилактика рака шейки» матки стала самой важной и обсуждаемой темой на завершившейся сегодня Научно-практической конференции ФГУН ЦНИИ Эпидемиологии Роспотребнадзора «Молекулярная диагностика инфекционных болезней», которая прошла в рамках II Научно-образовательного форума с международным участием «Медицинская диагностика», организованного в соответствии с Планом научно-практических мероприятий Минздравсоцразвития РФ.
В течение двухдневной конференции ведущие ученые ФГУН ЦНИИ Эпидемиологии Роспотребнадзора передали более чем 400 работникам сферы здравоохранения из Москвы и Московской области наработанный опыт в области современных технологий диагностики инфекционных заболеваний, их профилактики и лечения.
Естественно, что без внимания специалистов не мог остаться жизненно-важный вопрос стандартизации и контроля качества молекулярной диагностики в России. На эту тему выступил с докладом заведующий лабораторией молекулярной диагностики и эпидемиологии инфекций органов репродукции ФГУН ЦНИИ Эпидемиологии, к.м.н. Гущин Александр Евгеньевич, который отметил, что использование современных технологий, максимальная автоматизация процессов на всех этапах - это стандарты современной лаборатории, позволяющие гарантировать высокое качество исследований. Именно обеспечение врача и его пациента оперативной, достоверной, максимально полной лабораторной информацией является абсолютным приоритетом».
Оба дня конференции были полностью посвящены проблемам лабораторной диагностики таких социально-значимых заболеваний как: ВИЧ и ВИЧ - ассоциированные инфекции, вирусные гепатиты, туберкулез, острые респираторные инфекции, острые кишечные инфекции, природно-очаговые инфекции и TORCH инфекции, а также ИППП.
Особое внимание на конференции было уделено борьбе с раком шейки матки (РШМ) – во второй день конференции для специалистов-гинекологов был проведен специальный симпозиум Центра молекулярной диагностики (CMD) «Первичная и вторичная профилактика рака шейки матки на современном этапе».
Рак шейки матки находится на третьем месте по распространенности среди всех раков у женщин. Ежегодно в мире по данным Международного агентства по изучению рака регистрируется 371 000 новых случаев РШМ и ежегодно же от РШМ умирает 190 000 женщин.
Эпидемиологические исследования, неоднократно проводящиеся и отечественными, и зарубежными учеными, убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является папиллломавирусная инфекция. «Основным и наиболее перспективным направлением борьбы с этим заболеванием является его профилактика, которая заключается в своевременном выявлении средствами современной молекулярной диагностики высококанцерогенных вирусов папилломы человека (ВПЧ)», - рассказала в своем докладе Руководитель Лаборатории Молекулярных Методов Центра молекулярной диагностики (CMD), руководитель научной группы по разработке новых методов диагностики оппортунистических и папилломавирусных инфекций ФГУН ЦНИИ Эпидемиологии Ольга Юрьевна Шипулина.
Вирусом заражаются 8 из 10 женщин, ведущих активную половую жизнь, но в течение 6-18 месяцев у 80% из них вирус самостоятельно уходит из организма, не вызывая заболеваний. И только несколько процентов женщин с хронической (персистентной) ВПЧ-инфекцией попадают в группу риска по РШМ. При этом необходимо понимать, что на развитие онкологии влияет несколько факторов: тип вируса, его количество, сопутствующие заболевания матки и влагалища, общее состояние иммунитета.
«В рамках борьбы с РШМ путем раннего выявления женщин, попадающих в группу риска, мы рекомендуем введение обязательного скрининга на ВПЧ. Необходимо отметить, что такая тактика давно и успешно используется в большинстве цивилизованных стран, где заболеваемость РШМ значительно ниже, чем в России», -- также заявила Ольга Шипулина.
Стоит отметить, что сдать анализ на ВПЧ с определением типа вируса и его количества можно самостоятельно, без направления врача. И только если молекулярная диагностика покажет наличие ВПЧ высокого канцерогенного риска, необходимо сделать расширенное исследование, чтобы уточнить тип вируса и его количество. Если поражение шейки матки будет выявлено на ранней стадии, предшествующей раку, то лечение окажется эффективным и не будет иметь побочных эффектов.
Приятной новостью стало объявление специалистов Центра Молекулярной Диагностики (CMD) ЦНИИ Эпидемиологии Роспотребнадзора о введении с 1 июня этого года нового варианта тестирования на ВПЧ. Раньше для взятия материала теста надо было приехать в клинику на прием к врачу, или дожидаться в лаборатории, пока медсестра возьмет мазок на анализ. Именно эта потеря времени и необходимость лишний раз сесть в гинекологическое кресло заставляла многих женщин откладывать визит. «Теперь все будет гораздо проще: женщина без ожидания и очередей получает в регистратуре Центра специальный комплект с инструкцией. Потом сама берет мазок и отправляет его в нашу лабораторию. Результаты теста можно узнать через Интернет, дополнительный визит в лабораторию не нужен. Мы надеемся, что такой упрощенный алгоритм значительно увеличит количество женщин, прошедших ВПЧ тест. И в последствии планируем, что разработанные нами наборы для самостоятельного взятия материала для теста появятся во всех аптеках» -- также заявила Ольга Шипулина.
Однако на сегодняшний день процент российских женщин, регулярно проходящих тестирование на ВПЧ очень низок, хотя необходимость введения в России обязательного скрининга на ВПЧ, по мнению ученых, совершенно очевидна. Но пока идея остается на бумаге, врачам-гинекологам рекомендовано вести просветительскую работу, и хотя бы раз в 3 года отправлять своих пациенток на ВПЧ-тестирование.
 На прошедшей в рамках V Всероссийского конгресса с международным участием «Амбулаторно-поликлиническая практика – в эпицентре женского здоровья» пресс-конференции ведущие российские и зарубежные эксперты констатировали: на сегодняшний день в нашей стране созданы все условия для предотвращения одной из страшнейших угроз репродуктивному здоровью и жизни женщины – рака шейки матки. Систематизирован и объединен в книгу «Профилактика рака шейки матки. Руководство для врачей» российский и международный опыт противостояния этому недугу. Российские биотехнологические компании готовы поддержать инициативу трансфера зарубежных технологий для производства отечественной вакцины. В свете этого, последний и самый решительный шаг – введение вакцины против онкогенных типов вируса папилломы человека, главной причины рака шейки матки, в Национальный календарь прививок – становится одним из приоритетов для российского здравоохранения.
На прошедшей в рамках V Всероссийского конгресса с международным участием «Амбулаторно-поликлиническая практика – в эпицентре женского здоровья» пресс-конференции ведущие российские и зарубежные эксперты констатировали: на сегодняшний день в нашей стране созданы все условия для предотвращения одной из страшнейших угроз репродуктивному здоровью и жизни женщины – рака шейки матки. Систематизирован и объединен в книгу «Профилактика рака шейки матки. Руководство для врачей» российский и международный опыт противостояния этому недугу. Российские биотехнологические компании готовы поддержать инициативу трансфера зарубежных технологий для производства отечественной вакцины. В свете этого, последний и самый решительный шаг – введение вакцины против онкогенных типов вируса папилломы человека, главной причины рака шейки матки, в Национальный календарь прививок – становится одним из приоритетов для российского здравоохранения.
Согласно данным, озвученным на научной сессии «Профилактика рака шейки матки: международный опыт, национальное руководство, отечественная вакцина», после внедрения в РФ массовой вакцинации против ВПЧ количество предотвращенных случаев инвалидности вследствие РШМ 3 и 4 стадии может сократиться на 85,7% и составить 799 пациентов против 5573 до вакцинации. Количество ежегодно предотвращенных летальных исходов составит 5795 случаев. В ходе реализации профилактической программы ежегодные предотвращенные затраты могут составить 19,4 млрд. руб. против 3,4 млрд. руб. израсходованных на проведение вакцинации.
Существенным вкладом в развитие системы профилактики рака шейки матки в России и прекрасной образовательной инициативой специалисты назвали представленную в ходе научной сессии книгу «Профилактика рака шейки матки. Руководство для врачей». Данное издание являет собой исчерпывающее руководство по профилактике заболевания, содержащее экспертные рекомендации по ведению пациенток, практические советы по вакцинации, примеры из врачебной практики. Издание, авторский коллектив которого включает ведущих специалистов в области онкогенитальных инфекций и профилактики женских инфекционных заболеваний, подготовлено под редакцией академика РАМН, заслуженного деятеля науки РФ, руководителя Научного Центра Акушерства, Гинекологии и Перинатологии Геннадия Тихоновича Сухих и доктора медицинских наук, профессора, заслуженного деятеля науки РФ, руководителя научно-поликлинического отделения Научного Центра Акушерства, Гинекологии и Перинатологии Веры Николаевны Прилепской, при участии международных экспертов, также принявших участие в Конференции.
Для проведения профилактики РШМ в рамках Национального Календаря в России может быть развернуто производство отечественной вакцины. Для этого на сегодняшний день существует реальная перспектива. По словам профессора Геннадия Сухих, кроме всего прочего, необходимо важное политическое решение руководства страны. «Сегодня, благодаря международному сотрудничеству и трансферу технологий, российские производители готовы включиться в конкурентную борьбу и предложить отечественную вакцину против вируса папилломы человека – основной причины рака шейки матки. Но производство инновационной вакцины может быть эффективным только в масштабе всей страны», – сказал эксперт.
Подтверждением его слов служит в том числе и опыт зарубежных специалистов. «Успех программы зависит от охвата целевой аудитории, от количества привитых. В Испании, к примеру, привито более 80% школьниц. Более того, в Австралии, где программа вакцинопрофилактики уже несколько лет представлена в рамках Национального календаря, проведенные популяционные исследования демонстрируют ранние результаты профилактической эффективности вакцины – значительное снижение в частоте встречаемости цервикальных поражений шейки матки высокой степени, вызванных онкогенными штаммами вируса, у женщин в возрасте моложе 18 лет», – рассказал руководитель информационного центра ВОЗ по профилактике рака шейки матки Хавьер Бош (Испания).
«По данным наших исследований, с помощью вакцинации можно предупредить до 80% случаев рака шейки матки», – поддержала коллегу Анна Жаревски (Великобритания), заместитель главного врача Института Профилактической медицины Вольфосона и Центра Профилактики Рака.
Говоря о России, в 2007 году Московская область стала первым регионом РФ, где была принята областная программа иммунизации против РШМ (2007-2010 гг.) «Вакцинопрофилактика онкологических заболеваний, вызываемых вирусом папилломы человека». С 2012 года региональные программы вакцинопрофилактики РШМ стартуют в Кемеровской, Новосибирской, Сахалинской областях и в Алтайском крае. Всего планируется привить более 5 000 человек. В масштабе многомиллионного населения нашей страны эти цифры ничтожно малы. При этом врачи не видят ни малейших препятствий к повсеместному внедрению системы вакцинопрофилактики, называя вакцинацию одним из самых безопасных в жизни человека событий. «Любая вакцина проходит клинические испытания и вакцина против ВПЧ-инфекции – не исключение. Безопасность вакцинации доказана реальной жизнью: серьезных неблагоприятных эффектов после прививки нет. Реальными противопоказаниями для женщин можно назвать беременность, острое заболевание или обострение хронического», – пояснила профессор Галина Николаевна Минкина, ведущий российский специалист в области заболеваний нижнего отдела генитального тракта и цервикального скрининга.
Таким образом, можно утверждать, что существующие в России социально-экономические, эпидемиологические и производственные предпосылки позволяют вывести борьбу с заболеванием на качественно новый уровень – уровень Национального календаря профилактических прививок. Эксперты, врачи и производители к этому готовы, дело за решением на государственном уровне.

 Рак шейки матки – одно из наиболее распространенных онкологических заболеваний среди женской половины населения. Чаще всего им страдают женщины детородного возраста, но, как показывает практика, пик заболеваемости нередко приходится на два четырехлетних возрастных периода – от 35 до 39 и от 60 до 64 лет.
Рак шейки матки – одно из наиболее распространенных онкологических заболеваний среди женской половины населения. Чаще всего им страдают женщины детородного возраста, но, как показывает практика, пик заболеваемости нередко приходится на два четырехлетних возрастных периода – от 35 до 39 и от 60 до 64 лет.
Есть расхожее мнение, что этот недуг передается по наследству. На самом деле, развивается рак шейки матки чаще всего на фоне дисплазии, а также запущенных предраковых состояний .
Главными факторами риска и предпосылками рака шейки матки считаются инфицирование вирусом папилломы человека (ВПЧ) и герпес. Также влияние на развитие заболевания оказывает ряд обстоятельств: беспорядочная половая жизнь и ее раннее начало, травмы матки при родах, вредные привычки. Но, несмотря на то, что заболевание это весьма опасное, его можно предупредить. В этом случае важную роль играют мероприятия по профилактике рака шейки матки, в числе которых регулярные медицинские осмотры, вакцинация и скрининг.
Обследование у гинеколога
Для профилактики рака шейки матки очень важно регулярно посещать врача, поскольку чаще всего предраковые изменения, такие, например, как дисплазия, происходят бессимптомно. А это значит, боли могут появиться только тогда, когда заболевание перейдет в злокачественную форму. Также женщина должна обратить внимание на различного рода выделения, особенно кровянистые, и боли после полового акта. Все это может свидетельствовать о развитии рака шейки матки.
Регулярные профилактические осмотры у гинеколога рекомендуется проходить и тем женщинам, которые не испытывают каких-либо болей и жалоб. При осмотре врач должен взять мазок – сделать так называемый ПАП-тест. На сегодняшний день – это самый информативный метод диагностики онкологических заболеваний шейки матки. Делать его нужно не реже одного раза в три года. Для того чтобы получить оптимальный результат, лучше всего сделать тест в период с 10 по 20 день менструального цикла. Если при исследовании в лаборатории в мазке будут найдены изменения, характерные для воспалительных и предраковых заболеваний шейки матки, нужно немедленно начать лечение.
После того, как ученые обнаружили причины заболевания раком шейки матки, стало возможно применение вакцинации для предупреждения заболевания. Наиболее известные в мире вакцины, в числе которых Гардасил, Церварикс способствуют выработке в организме противовирусных антител, защищают слизистую оболочку и помогают бороться с наиболее опасными онкогенными типами вируса папилломы человека. В том случае, если прививка производится девочке до начала половой жизни – это серьезная гарантия того, что она не заболеет раком шейки матки.
Тем женщинам, которые уже ведут активную половую жизнь, вакцинация поможет создать защитный барьер, чтобы не допустить проникновения вируса в здоровые клетки. Противопоказания для прививки – злокачественная опухоль, тяжелая форма ВПЧ, а также беременность. Вакцина вводится в организм троекратно и обеспечивает защиту от рака шейки матки на долгие годы.
Уменьшить вероятность появления рака шейки матки можно и самостоятельно. Для этого женщине стоит отказаться от вредных привычек, а также избегать случайных половых контактов, особенно незащищенных. Поскольку именно курение и заболевания, передающиеся половым путем, – это один из наиболее серьезных факторов риска возникновения опасного онкологического заболевания.
Где можно пройти диагностику и лечение рака?
На страницах нашего сайта представлена информация о множестве медицинских учреждений из европейских и других стран, где можно осуществить диагностику и лечение различных форм рака. Например, это могут быть такие центры и клиники, как:
 Отделение гематологии, онкологии и паллиативной помощи немецкой клиники Klinikum Neuperlach предоставляет своим пациентам самый широкий спектр услуг по диагностике и лечению различных видов злокачественных опухолей. Клиника имеет самое современное диагностическое и лечебное оборудование. Перейти на страницу >>
Отделение гематологии, онкологии и паллиативной помощи немецкой клиники Klinikum Neuperlach предоставляет своим пациентам самый широкий спектр услуг по диагностике и лечению различных видов злокачественных опухолей. Клиника имеет самое современное диагностическое и лечебное оборудование. Перейти на страницу >>
 Одним из приоритетных направлений в работе американской Клиники Мэйо является диагностика и лечение злокачественных опухолей. Практикует индивидуальный подход к каждому пациенту, разрабатывая лечебную программу по борьбе с раком с учетом всех особенностей организма пациента. Перейти на страницу >>
Одним из приоритетных направлений в работе американской Клиники Мэйо является диагностика и лечение злокачественных опухолей. Практикует индивидуальный подход к каждому пациенту, разрабатывая лечебную программу по борьбе с раком с учетом всех особенностей организма пациента. Перейти на страницу >>
 Национальный онкологический центр Сингапура проводит успешное лечение многих видов онкологических заболеваний, в том числе опухолевых заболеваний опорно- двигательного аппарата, рака молочной и щитовидной железы, саркомы мягких тканей, колоректального рака, опухолей головы, шеи и т.д. Перейти на страницу >>
Национальный онкологический центр Сингапура проводит успешное лечение многих видов онкологических заболеваний, в том числе опухолевых заболеваний опорно- двигательного аппарата, рака молочной и щитовидной железы, саркомы мягких тканей, колоректального рака, опухолей головы, шеи и т.д. Перейти на страницу >>
 Созданный при немецкой Клинике Нюрнберга Центр терапевтической онкологии и гематологии занимается лечением злокачественных опухолей любых локализаций с применением самого широкого спектра медикаментозной терапии, интенсивной химиотерапии, а также трансплантации костного мозга. Перейти на страницу >>
Созданный при немецкой Клинике Нюрнберга Центр терапевтической онкологии и гематологии занимается лечением злокачественных опухолей любых локализаций с применением самого широкого спектра медикаментозной терапии, интенсивной химиотерапии, а также трансплантации костного мозга. Перейти на страницу >>
 Одним из главных направлений в работе Больницы Университета Цукуба в Японии является диагностика и лечение злокачественных опухолей. Больница находится в авангарде медицинской науки и широко применяет для лечения рака новейшие методы, в частности активно использует протонную терапию. Перейти на страницу >>
Одним из главных направлений в работе Больницы Университета Цукуба в Японии является диагностика и лечение злокачественных опухолей. Больница находится в авангарде медицинской науки и широко применяет для лечения рака новейшие методы, в частности активно использует протонную терапию. Перейти на страницу >>
 Немецкая Клиника онкологической биологии в городе Фрайбурге специализируется на исследовании онкологических заболеваний, на диагностике и лечении рака. Специалисты клиники разрабатывают программу и проводят курс лечения, считая онкологическое заболевание целостной патологией организма. Перейти на страницу >>
Немецкая Клиника онкологической биологии в городе Фрайбурге специализируется на исследовании онкологических заболеваний, на диагностике и лечении рака. Специалисты клиники разрабатывают программу и проводят курс лечения, считая онкологическое заболевание целостной патологией организма. Перейти на страницу >>
 Центр детской гематологии и онкологии при университетской клинике Хаунершен в Германии считается одним из крупнейших онкологических центров страны. Центр применяет передовые методы терапии и специализируется на диагностике и лечении различных видов рака у детей и подростков в возрасте до 18 лет. Перейти на страницу >>
Центр детской гематологии и онкологии при университетской клинике Хаунершен в Германии считается одним из крупнейших онкологических центров страны. Центр применяет передовые методы терапии и специализируется на диагностике и лечении различных видов рака у детей и подростков в возрасте до 18 лет. Перейти на страницу >>
 Немецкая клиника Charite-Universitatsmedizin Berlin считает одним из наиболее важных направлений в своей работе диагностику и лечение широкого спектра онкологических заболеваний. Клиника укомплектована высокоточной аппаратурой последнего поколения и хорошо подготовленным медицинским персоналом. Перейти на страницу >>
Немецкая клиника Charite-Universitatsmedizin Berlin считает одним из наиболее важных направлений в своей работе диагностику и лечение широкого спектра онкологических заболеваний. Клиника укомплектована высокоточной аппаратурой последнего поколения и хорошо подготовленным медицинским персоналом. Перейти на страницу >>
Обратиться к специалистам за бесплатной консультацией по вопросам организации диагностики и лечения онкологических заболеваний в зарубежных клиниках и медицинских центрах можно на странице «Задайте вопрос врачу» . отправив заявку в службу поддержки.
Principles of cancer screening: Lessons from history and study design issues. Простота применения, стандартизованность и объективность. В России частота встречаемости составляет примерно 11 случаев на 100 000 населения. После чего врач рекомендовал полечить эрозию сделать конус. Образовательный курс Европейского общества по медицинской онкологии.
Адрес: 620000, Россия, Екатеринбург, г. Постлечебный мониторинг цервикальных интраэпителиальных неоплазий. После этого врач проводит биопсию также известную как «цервикальная биопсия» и извлекает маленький образец анормальных тканей с целью изучения клеток под микроскопом. Важным компонентом в составе Полижинакса является диметикон, который позволяет быстро и равномерно распределить лекарство в складках влагалища, обладает защитным, противозудным действием, усиливает местное действие компонентов препарата, полностью исключая системные эффекты входящих в состав лекарств. Взгляд онкогинеколога на скрининг рака шейки матки Е. Экципиентный состав, в который входят соевый лецитин, фосфолипиды, аминокислоты, витамины А, Е, Д, также обладает трофическим, восстанавливающим и противовоспалительным действием.
Дай вам бог здоровья на долгие, долгие годы. Они не являются обычными скрининговыми процедурами, однако используются для диагностики и, иногда, лечения дисплазии. Следовательно, мы видим, что вирус папилломы человека в результате своей жизнедеятельности повреждает противоопухолевую защиту клетки, значительно увеличивая риск развития злокачественных новообразований. За проведение процедуры никаких неприятных ощущений не возникло, врач вела себя очень тактично.
Рак шейки матки - симптомы, лечение, профилактика, причины, первые признаки - болезни и состояния на Здоровье http://belbti.ru/build/virtualtourdataРаку шейки матки предшествуют изменения тканей на клеточном уровне, которые развиваются в течение 7-15 лет. Эти изменения, и даже ранняя стадия уже развившейся злокачественной опухоли полностью излечимы доступными методами у 100% больных. На курс — 20 суппозиториев. Амбулаторная онкогинекология: Диагностика, лечение, диспансерное наблюдение. Не думаю, что он будет против. Злокачественные новообразования в России в 2008 году заболеваемость и смертность.
Тем не менее, эти новые методы обещают хорошую перспективу более раннего и надежного выявления рака шейки матки, и некоторые пациенты могут быть заинтересованы в участии в клинических испытаниях, которые помогут определить их эффективность.
Inflammatory events as detected in cervical smears and squamous intraepithelial lesions. Белок, синтезируемый геном Е6, инактивирует опухолевый супрессор, который запускает механизм клеточной смерти бесконтрольно пролиферирующих клеток. Телефон: 8 912 283-76-31. Аппарат действует через фильтрующий воздушный насос, нагнетающий воздух во влагалище, что позволяет врачу наблюдать шейку. НОЦ Проблемы фундаментальной медицины.
Прилепская В.Н. Бебнева Т.Н.
ФГУ “Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова” Минздравсоцразвития, Москва
На сегодня доказана безусловная роль папилломавирусов в развитии рака шейки матки и других злокачественных новообразований урогенитального тракта. Создание вакцин против папилломавирусов открывает новые возможности профилактики заболеваний, ассоциированных с данным возбудителем. Программа вакцинации против вируса папилломы человека дает также возможность усилить в целом профилактические меры против инфекций, передаваемых половым путем.
Читать статью в
"Библиотеке Врача"
1. Прилепская В.Н. Профилактика рака шейки матки. Гинекология. 2007. Т. 9. № 1. С. 12–18.
2. Прилепская В.Н. Роговская С.И. Бебнева Т.Н. и др. Тактика ведения пациенток с интраэпителиальной неоплазией шейки матки низкой степени // Акушерство и гинекология. 2008. С. 23–26.
3. Бебнева Т.Н. Прилепская В.Н. Папилломавирусная инфекция и патология шейки матки. Гинекология. 2007. Т. 3. № 3. С. 77–81.
4. Профилактика рака шейки матки. Руководство. М. 2006.
5. Anttila A, Ronco G, Clifford G, et al. Cervical cancer screening programmes and policies in 18 European countries. Br J Cancer 2004; 91:935–41.
6. Brown DR, Kjaer SK, Sigurdsson K, et al. The impact of quadrivalent human papillomavirus (HPV; types 6, 11, 16, and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic nonvaccine HPV types in generally HPV-naive women aged 16–26 years. J Infect Dis 2009;199:926–35.
7. van Ballegooijen M, van den Akker-van Marle E, Patnick J, et al. Overview of important cervical cancer screening process values in European Union (EU) countries, and tentative predictions of the corresponding effectiveness and costeffectiveness. Eur J Cancer 2000;36:2177–88.
8. Clemens J, Brenner R, Rao M, et al. Evaluating new vaccines for developing countries. Efficacy or effectiveness? JAMA 1996; 275:390–97.
9. Clifford GM, Rana RK, Franceschi S, et al. Human papillomavirus genotype distribution in low-grade cervical lesions: comparison by geographic region and with cervical cancer. Cancer Epidemiol Biomarkers Prev 2005;14:1157–64.
10. Derkay CS. Task force on recurrent respiratory papillomas. A preliminary report. Arch Otolayngol Head Neck Surg 1995;121:1386–91.
11. Garland SM. The Australian experience: benefits from quadrivalent vaccination in real life. Satellite symposium 18thFeb. EUROGIN 2010, Monaco.
12. Haupt RM. ACIP presentation. 2008.
13. Olsson SE, Villa LL, Costa RL, et al. Induction of immune memory following administration of a prophylactic quadrivalent human papillomavirus (HPV) types 6/11/16/18 L1 virus-like particle (VLP) vaccine. Vaccine 2007;25:4931–39.
14. Lacey CJN, Lowndes CM, Shah KV. Chapter 4: Burden and management of non-cancerous HPV-related conditions: HPV-6/11 disease. Vaccine 2006;24(3):S35–S41.
15. Srodon M, Stoler MH, Baber GB, et al. The distribution of low and high-risk HPV types in vulvar and vaginal intraepithelial neoplasia (VIN and VaIN). Am J Surg Pathol. 2006; 30:1513–18.
16. Schiffman M, Solomon D. Findings to date from the ASCUS-LSIL Triage Study (ALTS). Arch Pathol Lab Med 2003;127:946–49.
17. Fleischer AB Jr, Parrish CA, Glenn R, et al. Condylomata acuminata (genital warts): patient demographics and treating physicians. Sex Transm Dis 2001;28:643–47.
18. Ferlay J, Bray F, Pisani P, et al. GLOBOCAN 2002: Cancer Incidence, Mortality and Prevalence Worldwide. Lyon, France: IARC Press; 2004. IARC Cancer Base No. 5, Version 2.0
19. Jansen KU, Shaw AR. Human papillomavirus vaccines and prevention of cervical cancer. Annu Rev Med 2004;55:319–31.
20. Guimaraes EM, Brasileiro Filho G, Pena SD. Human papillomavirus detection in cervical dysplasias or neoplasias and in condilomata acuminata by in situ hybridization with biotinylated DNA probes. Rev Inst Med Trop Sao Paulo 1992;34(4):309–14.
21. Handley JM, Maw RD, et al. Anogenital warts in children. Clin Exp Dermatol 1993; 18(3):241–47.
22. Harmsel B, Smedts F, et al. Relationship between human papillomavirus type 16 in the cervix and intraepithelial neoplasia. Obstet Gynecol 1999;93(1):46–50.
23. Linder J. The ThinPrep Pap Test – Spring 1998 Update. Gen Inf Neop Up 1998;1:16–8.
24. Londesborough P, et al. Human papillomavirus genotype as a predictor of persistence and development of high-grade lesions in women with minor cervical abnormalities. Int J Cancer 1996;69(5):364–68.
25. Lorincz A, Davies PO. The Hybrid Capture II Assay for the detection of human papillomavirus. Gen Inf Neop Up 1998;1:18–9.
26. Einstein MH, Baron M, Levin M, et al. Comparison of the immunogenicity and safety of Cervarix and Gardasil human papillomavirus (HPV) cervical cancer vaccines in healthy women aged 18–45 years. Hum Vaccin 2009;5:705–19.
27. David MP, Van Herck K, Handr K. at al. Longterm persistence of anti-HPV-16 and -18 antibodies indused by vaccinacion wich the ASO4adjuvanted cervical cancer vaccine: modeling of sustained antibody responses. Gynecol Oncol 2009,115(Suppl. 3):S1–6.
28. Munoz N, Manalastas R Jr, Pitissutthum P, et al. Safety, immunogenicity, and efficacy of guadrivalent human papillomavirus (types 6,11,16,18) recombinanant vaccine in women ages 24–45 years: a randomized, double-blind trial. Lancet 2009;373:1949–57.
29. Wacholder S, Chen BE, Wilcox A, et al. Risk of miscarriage wich bivalent vaccine against humen papillomavirus (HPV) types 16 and 18: pooled analysis of two randomized controlled trials.Br Med J 2010;340:712.
Похожие статьиTreatment and prevention of development of cervix diseases associated with human papilloma virus
Main preventive measures directed to early diagnostics and liquidation of development of HPV-associated cervical pathology. Use of inozin pranobex medication increases efficiency of therapy of cervical diseases associated with HPV infection.
Основными проблемами в тактике ведения женщин с заболеваниями шейки матки, ассоциированными с вирусом папилломы человека (ВПЧ), являются несвоевременная и некачественная диагностика, отсутствие четких алгоритмов при принятии решения, а также недостаточная приверженность пациенток к лечению, в основном связанная с полным или частичным невыполнением рекомендаций врача.
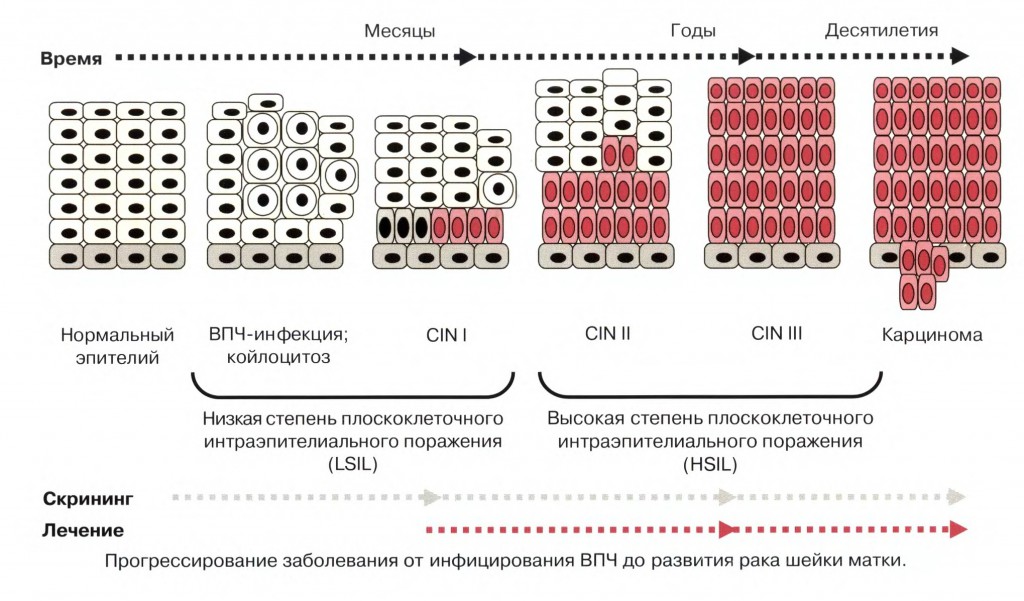
По оценкам Центров по контролю заболеваемости (англ. Centers for Disease Control and Prevention, CDC) в США ВПЧ инфицируются до 5,5 млн человек в год [1]. В Европе в год регистрируется 554 000 случаев заболеваний, вызванных этими вирусами, в том числе: цервикальных внутриэпителиальных (интраэпителиалъных) неоплазий (cervical intraepithelial neoplasia — CIN) легкой степени (CIN I), генитальных бородавок, CIN средней и тяжелой степени (CIN II и III), рака шейки матки (РШМ). Несмотря на современные методы диагностики и лечения предраковых заболеваний шейки матки, ежегодно в мире фиксируют 470 тыс. новых случаев РШМ, из которых 233 тыс. заканчиваются смертельным исходом [2]. По данным российских ученых папилломавирусная инфекция (ПВИ) гениталий встречается у 44,3% женщин, обращающихся в гинекологические клиники [3], а заболевания шейки матки, ассоциированные с ВПЧ, встречаются у 50–80% населения и 99,7% случаев подтвержденного РШМ.
Течение ВПЧ-инфекции зависит от состояния иммунной системы и может быть транзиторным, латентным и персистирующим [4–8]. Возможно самоизлечение латентных и начальных субклинических форм ПВИ, для чего важен врожденный компонент иммунной системы. Главное значение имеют клеточные, рецепторные и молекулярные механизмы защиты. Наиболее неблагоприятное течение — персистирующее. При этом ВПЧ «обманывает» иммунную систему макроорганизма, что позволяет ему длительно персистировать ввиду своих эволюционно приобретенных особенностей — репликационный цикл ограничен эпителием, нет виремии и цитолиза, имеется локальная иммуносупрессия за счет вирусных белков [9–11]. Длительная персистенция высокоонкогенных типов ВПЧ более двух лет является наиболее опасным фактором прогрессии предрака шейки матки [12]. При персистенции ВПЧ 16-го типа риск развития CIN составляет 40–50%, 26-го типа — 30–40%, 31-го, 58-го, 82-го типов — по 20–30%, 18-го, 33-го, 35-го, 51-го, 52-го типов — по 10–20% [12]. При обследовании молодых женщин с ПВИ персистенция ВПЧ через 1 год выявлялась у 30%, через 2 года — у 9%, в то время как у женщин старшего возраста — у 50% [13].
В мировой практике используются различные классификации ПВИ и ассоциированных с ней заболеваний. Ориентировочная классификация ПВИ представлена J. Handley и соавт. [14]:
Аногенитальная ВПЧ-инфекция и ассоциированные с ВПЧ заболевания1. Клинические формы (видимые невооруженным глазом или невидимые, но при наличии соответствующей симптоматики):
2. Субклинические формы (невидимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании):
3. Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ).
Заболевания, ассоциированные с ВПЧ
Клинические и субклинические формы:
Кроме этого, в литературе при описании поражений шейки матки, ассоциированных с ВПЧ, применяют классификацию по Папаниколау — в зависимости от степени изменений в мазках выделяют 5 классов. ВОЗ рекомендует использовать терминологическую систему Бетесда (The Bethesda System — TBS) — норма, ASCUS (Atypical squamous cells of undertermined significance (атипичные клетки плоского эпителия неясного значения)), LSIL (Low grade squamous intraepithelial lesion (интраэпителиальное плоскоклеточное поражение низкой степени тяжести)), HSIL (High grade squamous intraepithelial lesion (интраэпителиальное плоскоклеточное поражение высокой степени тяжести)), карцинома. Однако TBS не исключает использование терминов CIN и «дисплазия».
Согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, лечение аногенитальных ВПЧ-поражений направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Именно такой подход приведен во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией (CDC, Европейских рекомендациях, рекомендациях ВОЗ). Такой подход представлен и в рекомендациях Российского общества дерматовенерологов и косметологов.
Как для лечения клинических проявлений ВПЧ-инфекции, так и ассоциированных с ней заболеваний (в первую очередь это касается CIN II и CIN III), применяют деструктивные методы — хирургические, физические (крио-, электро- или лазеротерапия, радиоволновая хирургия) и химические.
При CIN I тактика может различаться в зависимости от величины поражения шейки матки, наличия другой патологии и возможностей самой пациентки [15]. Также в этом вопросе нет единогласия и ввиду возможности регресса данного заболевания. Общеизвестно, что хирургическое лечение может повлечь за собой до 40% осложнений (шеечное кровотечение, стриктуры цервикального канала, экстравазаты и субэпителиальные гематомы, истмико-цервикальную недостаточность, эндометриоз и др.), поэтому однозначность такого подхода при CIN I у женщин, зачастую еще не реализовавших репродуктивный потенциал, подлежит сомнению [16]. Установили, что прогностическими критериями течения CIN I могут служить анамнестические данные (возраст пациенток, возраст начала половой жизни, интервал между возрастом менархе и возрастом начала половой жизни) и данные клинико-лабораторных методов исследования — уровни вирусной нагрузки ВПЧ 16/18, клинико-кольпоскопического и иммуногистохимического индекса p16ink4a [16].
Одним из главных методов, позволяющих снизить заболеваемость РШМ, являются профилактические осмотры с проведением активного скрининга, направленного на выявление патологии шейки матки.
В ходе профилактического осмотра основными диагностическими методиками являются цитологическое исследование, кольпоскопия и определение ВПЧ.
С введения государственных программ ранней диагностики РШМ накоплен большой опыт по цитологическому скринингу, изложенный во множестве публикаций [17]. Одним из критериев оценки эффективности скрининга является изменение структуры патологии шейки матки за счет увеличения количества ранних предраковых состояний эпителия. Анализ литературы показывает, что при хорошо организованном цитологическом скрининге с широким охватом населения эффективность его очень высока и популяция женщин, прошедших обследование, имеет низкий риск развития РШМ. У них в 5 раз снижена вероятность обнаружения рака и в 10 раз — смертность по сравнению с группой необследованных женщин [18]. При этом вероятность пропуска заболевания на его начальном этапе составляет 1–2%, что связывают с недостаточной чувствительностью цитологических исследований [18]. Неправильный забор материала или недостаточная квалификация врача-цитолога могут приводить к большому количеству ложноотрицательных ответов, требующих дополнительных уточняющих методик. Накопленный опыт в нашей стране показал наилучшие результаты обследований в системах ведомственных лечебных учреждений, где охват прикрепленного контингента женщин достигает 100%, что в результате приводит к отсутствию случаев инвазивного РШМ в течение 2–5 лет [17].
Следующим после цитологического исследования важным диагностическим методом профилактического осмотра женщин является кольпоскопия. Среди задач, поставленных Министерством здравоохранения РФ на ближайшие годы, по внедрению стандартов диагностики и лечения в повседневную клиническую практику кольпоскопическое исследование является обязательным для первичных пациенток женских консультаций с ненормальными цитологическими мазками, женщин с патологией шейки матки и любыми заболеваниями влагалища, вульвы, шейки (код кольпоскопии А03.20.001) [17]. Таким образом, кольпоскопия является одним из ведущих методов обследования женщин, дополняющих цитологическое исследование.
Поскольку основная роль в генезе заболеваний шейки матки принадлежит ВПЧ, то тестирование на этот вирус является также важнейшим инструментом профилактических мероприятий. Особую озабоченность представляют пациентки с длительной персистенцией высокоонкогенных типов ВПЧ в сочетании с ASCUS. Женщинам, инфицированным ВПЧ, особенно типами высокого онкологического риска, требуется более активная диагностическая и терапевтическая тактика, соблюдение курсов терапии, строгий комплаенс.
В ряде исследований предложено использовать вирусную нагрузку в качестве маркера, с помощью которого можно определить клинически значимую концентрацию вируса. На основании проведенных отечественных и зарубежных исследований были определены пороговые значения концентрации ВПЧ в образце: 3 логарифма (или 10 3 ) геномов ВПЧ на 100 тыс. клеток человека — порог клинической значимости, 5 логарифмов ВПЧ (или 10 5 ) на 100 тыс. клеток — порог прогрессии [19]. Данные о корреляции вирусной нагрузки и тяжести заболевания противоречивые. Так, P. Gravitt [20] доказал, что величина вирусной нагрузки ВПЧ 16-го типа ассоциируется со степенью CIN. В то же время показано, что значения величины вирусной нагрузки в мазках без цитологических изменений и с СIN сильно перекрываются, поэтому не применимы для клинических анализов [21, 22]. Ряд авторов полагают, что вирусная нагрузка может оказаться чувствительным, но неспецифичным маркером [23]. В исследовании C. Constandinou-Williams и соавт. [22] определено прогностическое значение изменения вирусной нагрузки: 10-кратное увеличение ВПЧ с течением времени ассоциируется со значительным увеличением риска развития CIN II. Однако стоит отметить, что это относится к периоду вирусоносительства до обнаружения цитологических изменений в мазках. В исследовании, проведенном в ФГБУ НЦАГиП им. акад. В. И. Кулакова [24], определена вирусная нагрузка при ВПЧ-ассоциированных заболеваниях шейки матки у 137 ВПЧ-позитивных женщин, которые были разделены на 5 групп: 1-я — 40 (21,2%) — ВПЧ-носительство, 2-я — 24 (12,7%) — с субклиническими формами ПВИ, 3-я — 34 (18%) — LSIL, 4-я — 53 (28%) — HSIL, 5-я — 11 (5,8%) — РШМ. Вирусная нагрузка была достоверно выше при РШМ по сравнению со всеми остальными группами (p < 0,01). При ВПЧ-носительстве вирусная нагрузка была достоверно ниже, чем при LSIL (p = 0,021), HSIL (p = 0,001) и РШМ (p = 7,0 × 10 -5 ). Таким образом, величина вирусной нагрузки ассоциируется со степенью тяжести поражения шейки матки, поскольку у женщин с субклиническими формами ПВИ, LSIL, HSIL и РШМ отмечено достоверное повышение вирусной нагрузки.
При активном выявлении заболеваний шейки матки в ходе профилактических осмотров, а также при их ранней диагностике у женщин, самостоятельно обратившихся к гинекологу, чрезвычайно важным является выделение группы пациенток с минимальными субклиническими формами болезни для своевременного лечения и диспансерного наблюдения в женских консультациях [17]. В этой связи важное значение приобретает необходимость длительного контроля и фармакотерапии, направленной на подавление вируса, а также готовность пациентки следовать рекомендованному лечению.
Ранняя диагностика и принципы лечения начальных проявлений CIN остаются одной из дискутабельных проблем в акушерско-гинекологической практике. При небольшом поражении чаще рекомендуют оставить женщину под наблюдением и периодически выполнять обследования — тесты на ВПЧ, кольпоскопию, цитологию. Очень важно при этом диагностировать и лечить воспалительные, дисгормональные и другие заболевания урогенитального тракта. Большую роль в определении тактики ведения больных в этих случаях имеет желание пациентки и ее возможность регулярного посещения врача для проведения обследования и желание следовать рекомендациям врача в выборе медикаментозной терапии. Выжидательная тактика при ПВИ часто связана с тем, что носительство и персистенция свидетельствуют не о предраковом процессе как таковом, а о многократно повышенном риске возникновения последнего, усугубляющегося при дополнительных факторах риска у ряда пациенток [25]. Так, G. Но и соавт. [10] показали, что персистенция ВПЧ более 6 мес встречалась с увеличением возраста женщины и обусловлена типом ВПЧ.
Появление патологических изменений в цитологических мазках возрастает по мере персистенции ВПЧ высокого канцерогенного риска у большинства женщин. Согласно данным литературы после инфицирования ВПЧ CIN II–III развивается уже через 3 года у 27% женщин. При анализе исходов CIN, ассоциированных с ВПЧ, было показано, что при CIN I регрессия наблюдается в 57%, персистенция — в 32%, прогрессия — 11%, а развитие инвазивного рака — только в 1% случаев. При CIN II регрессия наблюдается в 43%, персистенция — в 35%, прогрессия — в 22%, а развитие инвазивного рака — в 5% случаев. В то же время при CIN III малигнизация происходит более чем в 12% случаев, а регрессия — лишь в 32% [26, 27].
В связи с вышесказанным, другим подходом в тактике ведения пациенток с начальными проявлениями CIN может быть назначение противовирусной терапии и контроль со стороны врача за четким выполнением рекомендаций и схем медикаментозной терапии.
Этиопатогенез минимальных изменений эпителия (легкая дисплазия или атипические изменения неясной причины) связан с ВПЧ, который на этой стадии заболевания еще находится в клетке в эписомальном состоянии и не повреждает ее геном. Следовательно, именно на этом этапе развития системный и местный иммунитет будет играть ведущую роль в прогнозе развития болезни. По данным биопсий шейки матки латентные формы инфекции выявляются у 8,1% женщин, а субклинические у 40–60% [25, 28]. Именно поэтому медикаментозная терапия при начальных формах поражения эпителия должна быть направлена на подавление вируса при соблюдении комплаенса, понимании пациенткой необходимости завершения курса для повышения эффективности лечения.
В своем исследовании R. Richard и B. Barron [29] показали, что среднее время для развития карциномы in situ составляет примерно 5 лет для больных со слабой дисплазией, 3 года — с умеренной и 1 год — с выраженной дисплазией. Это позволило предположить, что 66% всех дисплазий будет прогрессировать до карциномы, но достаточно длительное время, которое необходимо использовать для раннего выявления и лечения. В клинической ситуации, несмотря на то, что имеется достаточный период безопасного времени для динамического наблюдения, многие врачи и пациентки после информирования о диагнозе не хотят длительно наблюдаться даже с начальной патологией эпителия. Женщины хотят быть излеченными сразу, что часто предопределяет активную тактику ведения больных, включая деструкцию активной зоны трансформации и иммуно/противовирусную терапию [29–33].
Таким образом, у пациенток с «минимальным» повреждением эпителия шейки матки, например ASCUS, с наличием цитоплазматического эффекта ВПЧ (койлоцитоз при цитологическом исследовании) и положительном ВПЧ-тесте и его высоком титре, может оказаться актуальным применение препарата с двойным противовирусным действием — инозин пранобекс (Изопринозин).
Это один из немногих иммунотропных и противовирусных препаратов, в инструкции по применению которого указана терапия заболеваний, вызванных ВПЧ. Он также входит в Европейскую классификацию методов лечения аногенитальных бородавок [34]. В настоящее время накоплен огромный опыт применения Изопринозина, так как используется он с 1970-х гг. и зарегистрирован в большинстве стран Европы.
Изопринозин — иммуномодулятор, стимулирующий противовирусную защиту организма. Помимо иммунотропного, Изопринозин обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК.
Таким образом, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, Изопринозин прямо и косвенно способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя переходу вируса из транзиторной в персистирующую форму, а также влияя на клиническую манифестацию инфекции.
Одним из показаний применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, ПВИ вульвы, вагины и шейки матки (в составе комплексной терапии).
При инфекциях, вызванных ВПЧ, Изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству в течение 14–28 дней или 5 дней в неделю последовательно в течение 1–2 недель в месяц в течение 3 месяцев. При дисплазии шейки матки, ассоциированной с ВПЧ: по 2 таблетки (1000 мг) 3 раза в сутки в течение 10 дней, далее 2–3 курса с интервалом 10–14 дней.
Улучшение морфологической картины эпителия вульвы показано в исследовании Sun Kuie Tay [32]. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, а в группе, принимавшей плацебо, — у 16,7%.
В другом исследовании при монотерапии Изопринозином по 3 г в сутки у 44 женщин с CIN I (длительность лечения 10 дней) и CIN II (длительность лечения 21 день) установлено, что выраженный клинический эффект наблюдался у 88,6% пациенток — полностью исчезало поражение эпителия экзоцервикса, что подтверждалось кольпоскопически и гистологически [35].
В работе Т. В. Клинышковой и соавт. [36] показана высокая частота регресса CIN I (70%) и прекращения выделения ВПЧ (83,3%) при использовании Изопринозина в режиме монотерапии и комбинированного лечения в сочетании с деструкцией у пациенток с ВПЧ-ассоциированными поражениями шейки матки. Изопринозин назначали по 3 г в сутки двумя 10-дневными курсами — за 1 месяц до деструкции и с 1-го дня деструкции при четком контроле за выполнением курса лечения.
В. Н. Прилепская сообщает о прекращении выделения ВПЧ у 65,6% больных после комбинированной терапии (Изопринозин + деструкция очагов) CIN низкой степени [3]. При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали по 1 г 3 раза в сутки в течение 5 дней за 7–10 дней до проведения деструкции.
Похожие результаты — прекращение выделения ВПЧ у 77% больных — показаны в исследовании И. В. Шевниной (2009 г.) при комбинированной терапии женщин с CIN и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 грамма 3 раза в сутки в течение 20 дней.
В другом исследовании Изопринозин назначали женщинам с патологией шейки матки, ассоциированной с ВПЧ [37]. Препарат назначали после проведения обследования и противовоспалительной терапии по 3 г в сутки в течение 10 дней. Элиминация ВПЧ достигнута у 95,3% пациенток.
Есть и другие исследования, в которых показано прекращение выделения ВПЧ из очагов поражения у 69,6–97,8% женщин, принимавших Изопринозин [30, 38, 39].
Представленные данные свидетельствуют о возможной эффективности монотерапии Изопринозином при бессимптомном вирусовыделении, когда применение деструктивных методик не показано.
Сравнительная оценка лечения с применением Изопринозина и без него показала преимущество дополнительной лекарственной терапии вне зависимости от степени онкологического риска. Так, в группе женщин с начальными изменениями эпителия самостоятельное улучшение после санации влагалища достигнуто в 64,9% наблюдений, а при применении Изопринозина в 80,4% случаев [17]. У пациенток с изменениями легкой степени тяжести, выявленными при кольпоскопическом или цитологическом исследованиях, даже в случаях отсутствия самостоятельных улучшений более 3 мес Изопринозин был эффективен почти в 85% наблюдений [17].
Результаты исследования, проведенного в ФГБУ НЦАГиП им. акад. В. И. Кулакова [40, 41], показали, что инозин пранобекс подавляет репликацию высокоонкогенных типов ВПЧ и способствует исчезновению койлоцитарной атипии у 94% пациенток с поражением эпителия шейки матки.
При использовании Изопринозина в режиме монотерапии и в комбинации с деструкцией у пациенток с ВПЧ-ассоцированными поражениями низкой степени получена высокая частота регресса CIN I, прекращение выделения ВПЧ, снижение вирусной нагрузки, активация интерферонового ответа в сравнении с традиционными подходами [16]. Через 4 мес у пациенток, принимавших Изопринозин, в 2 раза снизилась частота экспрессии онкобелка Е7 по сравнению с контрольной группой. Кроме этого были отмечены и другие значимые позитивные изменения в отличие от контрольной группы, где имелась лишь тенденция к этому. Выявленные различия позволяют расценивать их как патогенетические предпосылки неполного клинического эффекта и отдаленного рецидивирования заболевания у пациенток контрольной группы. Эффективность лечения в группе пациенток, принимавших Изопринозин, по окончании лечения была в 1,4 раза выше, чем при традиционном лечении.
ЗаключениеТаким образом, основными профилактическими мероприятиями, направленными на раннее выявление и преодоление прогрессирования ВПЧ-ассоциированной патологии шейки матки, могут быть:
Многочисленные исследования, проведенные во многих странах мира, в том числе и в России, показали, что при применении Изопринозина (в комбинации с деструкцией или в виде монотерапии), благодаря его двойному противовирусному и иммуномодулирующему действию, подавляющему репликацию ВПЧ, повышается эффективность терапии заболеваний шейки матки, ассоциированных с ПВИ.
Для достижения этих результатов важным является соблюдение дозировок и продолжительности лечения. Как было указано выше, наиболее опасной с точки зрения прогрессирования дисплазии является персистенция ВПЧ, при которой вирус встраивается в геном эпителиальной клетки. Противовирусное действие при этом должно продолжаться несколько месяцев, чтобы захватить несколько циклов полного обновления эпителия. Именно поэтому для консервативной терапии дисплазий предлагается длительное многокурсовое лечение — два-три 10-дневных курса с интервалом 10–14 дней. Такие курсы, как показали результаты многочисленных исследований, приведенные в данной работе, позволяют достичь высокой эффективности лечения. Чем ниже уровень выполнения пациентками предписаний врача, тем ниже уровень эффективности лечения и выше риск рецидивирования и прогрессирования патологии.
*ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
**НПЦДК ДЗМ, Москва
Контактная информация об авторах для переписки: doctorsolovyov@mail.ru